2. 湖南省农田杂草防控技术与应用协同创新中心, 湖南 娄底 417000
2. Collaborative Innovation Center of Farmland Weeds Control, Loudi 417000, China
以往环境中污染物主要是疏水性或中性化合物, 这些物质具有较强的脂溶性, 通常被固体颗粒吸附。随着人工合成化合物的增加, 更多的外源物质是更亲水的、含有可电离基团的化合物。据估计, 可电离有机化合物种类占欧盟登记活性物质种类的25%, 目前农业生产上使用的农药大多数为可电离农药, 包括磺酰脲类、苯氧羧酸类等[1]。FRANCO等[2]通过对1 510种在欧盟登记的化合物进行分析, 有49%的化合物在自然环境下可电离, 酸性物质约占27%, 碱性物质占14%, 两性离子占8%, 约33%的化合物在pH值为7时可电离。可电离有机化合物(ionizable organic compounds, IOCs)一般指包含酸性或碱性功能团, 酸性物质解离常数(pKa) < 12或碱性pKa > 2, 在环境pH范围内可以全部或部分电离的化合物[3]。相比于中性分子, IOCs在不同pH环境中会以不同形式存在, 从而可能导致其不同的生物有效性。因此, 笔者从环境中可电离有机污染物的特性出发, 综述各类因素对于可电离有机污染物生物有效性的影响机制, 并分析常用的评价方法用于IOCs生物有效性评价的可行性。
1 生物有效性定义在以往的研究中, 研究人员利用实验室暴露实验得到的基于污染物名义浓度对生物暴露的剂量-效应关系和野外实验所得出的实测数据制定环境标准[4]。但由于用污染物浓度来表述生态毒性的方法受到各种环境因素的影响, 如pH(影响可电离污染物的形态、溶解度等)、温度(污染物的扩散与生物体活性)、湿度(绝大部分气体污染物扩散系数随空气湿度增大而增大)[5]等因素, 从而导致污染物生态毒性的变化。因此, 有学者提出利用生物有效性来表征污染物被生物利用的程度及潜在毒性。
生物有效性概念现被广泛应用于医学、环境科学等领域, 但尚没有一个完全统一的定义。对动物科学来说, 生物有效性代表了化学药品穿过细胞膜进入细胞的可能性[6];对环境科学而言, 生物有效性指化学药品被生物同化、吸收和对生物可能的毒性, 即环境中的一部分化学污染物可能与环境介质(如土壤中的有机质或水中的溶解态有机质)相结合而无法被生物吸收, 即没有生物有效性[7]。就土壤环境而言, 污染物的生物有效性指能和土壤生物相互作用的化合物的量[8]。LANDRUM等[9]将污染物的生物有效性分为环境有效性、环境生物有效性以及毒理学生物有效性3类。SEMPLE等[10]还给出了“生物有效性”和“生物可及性”的定义。生物有效性指在一定时间内能够从生物体生活的基质中自由穿过生物膜的化合物; 生物可及性指如果生物体能够接触该化合物, 则该化合物能够从环境中穿过机体生物膜, 同时强调该化合物必须是能够自由移出有机体, 或者在一段时间后表现出生物有效性。生物可及性实际说明其不仅包含现有的生物有效性, 也包含潜在的生物有效性。由于影响生物可及性的不确定因素更多, 笔者主要针对生物有效性进行综述。纵观上述定义, 发现关于生物有效性的核心都是一致的, 只是不同领域研究者所强调的侧重点不同。环境科学家主要关注生物体能接触化合物量的多少;而对动物学家来说, 由于动物使用的化合物剂量是已知的, 他们更关注化合物在动物体内的一系列转运及代谢过程。笔者认为, 生物有效性比较通用的定义为化合物到达生物体作用靶标导致的毒性或在生物体内富集的程度。在复杂环境中, 生物有效性的影响包括以物理化学作用为驱动机制的吸附解吸过程和以生理学作用为驱动机制的吸收过程。对中性有机化合物而言, 生物对其吸收的过程不受存在形式的影响, 可主要考虑前者;对IOCs来说, 两个过程必须同时考虑。
2 影响IOCs吸附过程的主要因素在土壤或底泥环境中, 污染物的生物有效性主要受到矿物质种类、粒度分布、含水量、结构、pH值、温度、金属含量、含碳有机质、孔隙率、密度、老化和污染历史等[11]因素的影响, 而大多数因素直接或间接影响土壤或底泥对污染物的吸附。吸附增大会导致污染物被生物利用有效量降低, 从而降低其生物有效性。对IOCs而言, 环境介质中pH值、有机质含量和黏土含量等在IOCs的吸附过程中起到至关重要的作用。BERGLOF等[12]对越南4种土壤的研究发现, 随着有机质含量和黏土含量的增加, 土壤对于多菌灵(pKa=4.2) 的吸附量增大, 其吸附系数(Kf)从12.3上升至34.7, Kf与土壤有机质含量的决定系数R2达0.92, 与土壤黏土含量的R2达0.73。
但相比于疏水性化合物, IOCs更容易受到环境中pH的影响, 从而改变土壤或底泥对其的吸附, 进而影响生物有效性。pH对IOCs吸附的影响主要包括3种情况(图 1[13])。
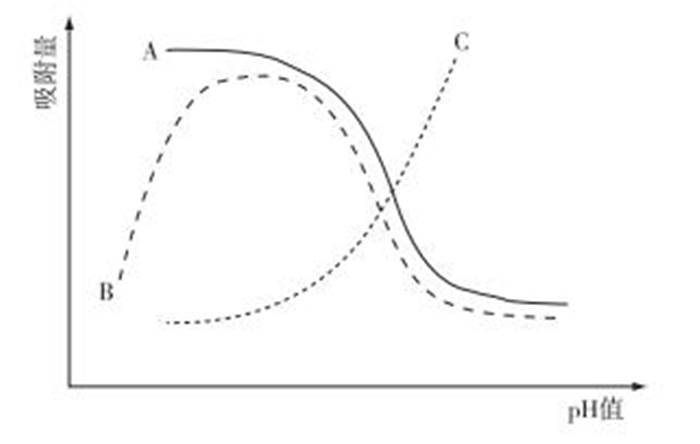
|
图 1 IOCs在不同pH值土壤中的3种吸附曲线[13] Figure 1 Adsorption curves of IOCs in the soil as a function of soil pH |
图 1显示,曲线A表示吸附量和pH值呈现负相关, 弱酸一般符合曲线A。FRANCO等[14]发现, 弱酸性化合物在pH值低于pKa时, 主要以中性分子形式存在, 其疏水性增加, 土壤对其吸附能力通常较强。这主要是因为中性分子不与土壤表面的负电荷排斥, 疏水性较离子大得多, 使得低pH值时吸附量较大[15]。张伟等[16]研究表明水-土壤系统的pH值越低, 土壤对弱酸性除草剂苄嘧磺隆(pKa=5.2) 和甲磺隆(pKa=3.75) 的吸附能力越强, 反之吸附能力减弱。HYUN等[17]研究发现土壤对疏水性五氯苯酚(pKa=4.75) 的吸附量比其阴离子高2个数量级。LIU等[18]通过对土壤吸附烟嘧磺隆(pKa=4.78) 的研究发现, 随着土壤有机质含量的上升, 其Kf与土壤有机质含量、黏粒含量之间呈显著正相关, 而当有机质含量和pH值均降低时, 土壤对烟嘧磺隆的吸附能力显著提高;可能是因为低pH值导致土壤溶液中烟嘧磺隆中性分子比例增加, 而土壤对中性分子的吸附能力比阴离子更强。
曲线B代表大多数弱碱的吸附量与pH值之间的关系。吸附量随着pH值的降低而增大, 达到最大值后降低, 当pH值等于pKa时, 吸附量达最大。弱碱性化合物在pH值低于pKa时, 主要以阳离子形式存在, 疏水性降低, 因此环境对其吸附量降低。SUN等[19]通过研究己胺、三甲胺、甲萘胺和苯胺的吸附时发现, 阳离子胺比中性分子胺会产生更强的吸附。但有研究表明, 阳离子也会被土壤中带负电的胶体吸附。这种影响通常导致当pH值等于pKa时吸附量最大[14]。在pH值较低环境下吸附曲线下降的原因是:(1) 阳离子和其他阳离子之间(如氢离子和铝离子)对阴离子吸附的竞争; (2) 阳离子增加可减弱化合物和腐殖酸间的疏水作用; (3) 有机质酸性官能团的电离影响吸附机理, 可能降低氢键结合作用;(4) 当酸性化合物在某些已电离氧化物的表面被吸附时, 其阴离子浓度会降低[1]。
曲线C表明随着土壤pH值的增大, 吸附能力增强。主要以中性分子形式吸附的弱碱符合这种曲线。这是因为在pH值 < 8的溶液中, 其阳离子交换量(氢离子)已经饱和, 而在碱性溶液中并未饱和。FRUHSTORFER等[20]研究发现当阿特拉津(pKa=1.7) 被蒙脱石组分土壤吸附时, pH值为9.5时的吸附量远大于pH值为4.5时的吸附量。DE JONGE等[21]发现草甘膦(pKa=2.34) 土壤吸附量和环境介质pH值之间呈显著正相关。
综上可知, 相比于疏水性有机化合物, 土壤中IOCs生物有效性更易受到pH值的影响, 从而改变土壤中IOCs存在形式, 影响土壤对IOCs的吸附进而改变孔隙水中污染物浓度, 影响生物吸收。
3 环境介质pH值对IOCs生物吸收与生物富集的影响 3.1 电离对IOCs生物吸收的影响环境中pH值的变化会影响IOCs的电离形式, 从而影响生物体对IOCs的吸收。当pH值小于pKa时, 弱酸性化合物主要以中性分子形式存在, 疏水性更强, 更容易穿透生物膜, 具有更高的毒性。KONEMANN等[22]发现当pH值从8降低到6时, 五氯苯酚(pKa=4.75) 对鱼的毒性增加约10倍。李建华等[23]研究了pH和硬度对于受试药物对大型溞急性毒性的影响, 发现在试验pH值范围(6~10) 内, 随着pH值的增大, 2, 4, 6-三氯酚(2, 4, 6-TCP)(pKa=6.35) 和五氯酚(PCP)对大型溞急性毒性的影响显著降低, 硬度对于2种药物的毒性没有明显影响。这是因为氯酚类物质的毒性主要由其分子态贡献, 而pH值的升高促使分子态向离子态转化,从而使其毒性降低。
弱碱性化合物则相反, 当pH值大于pKa时, 主要以中性分子形式存在, 毒性更强。INOUE等[24]研究发现大麦在pH值为8环境下摄取氨类物质的量最大, 当pH值小于5时, 摄取量显著降低。RENDAL等[25]发现氯喹(pKa=4.1) 对水蚤(Daphnia magna)的毒性随pH值的增加而增大, 在pH值为7时的LC50(致死浓度)值约为pH值为9时LC50值的6倍。
究其原因, 在不同的电离条件下, IOCs穿透细胞膜的能力不同, 对于疏水性有机化合物(非离子化有机物)而言, 植物吸收时其多累积在脂质中[26], 或累积在植物细胞壁内[27], 动物吸收方面的报道鲜见。而吸收IOCs时容易受到pH的影响从而改变其电离程度, 其渗透性发生变化, 会出现离子障(ion trap)现象, 即细胞膜对于中性分子的渗透性要强于离子, 如果细胞内外pH值有差异, 则化合物在细胞内部电解从而导致无法与细胞外化合物浓度达到平衡[28]。疏水性有机化合物不会受到pH的影响而改变生物有效性, 这是两者最主要的区别。
因此, 对于弱酸或者弱碱性化合物而言, 其电离形式的毒性相比于分子形式的毒性减弱很多, Henderson-Hasselbalch方程为A/B=10C, 其中,A和B分别为物质质子形式和中性形式在环境中的浓度, C为pKa值与pH值之差。该方程可用于计算环境中IOCs中性分子的比例, 但需注意直接用环境中化合物总浓度计算时, 可能会低估或高估污染物生物有效性。BOSTRÖM等[29]设定2种数学模型。一种为吸收机理模型, 对弱酸有lg μ=lg α-lg [1/(1+10β-γ)], 对弱碱有lg μ=lg α-lg[1/(1+10γ-β]。其中, μ为EC50, 指50%影响浓度;α为EC50,中性,指未电离分子毒性;β为IOCs处于中性时环境pH值;V为pKa, 指物质化学分配常数。另一种为线性模型, 根据所测得数据直接计算, 有lg μ=a+bβ, 其中, a为截距, b为直线斜率。该模型用于评估IOCs在中性环境下和受环境pH影响时两者对大型溞EC50值的差值, 两者平均差值可达到3个数量级, 发现IOCs对生物体的毒性主要受其电离形式的影响, 而pH为其主导因素。RENDAL等[30]总结3个过程可以用来解释pH对IOCs毒性和生物累积的影响:(1) 化合物的电离减弱它的亲脂性, 因此降低其对水生生物的毒性和生物累积; (2) 离子捕获可能导致化合物在细胞中累积, 此与亲脂性吸收无关; (3) 电吸引可能与阳离子有关。
研究者在研究离子态对毒性是否有贡献时, 部分学者认为离子态对污染物毒性没有贡献, 如对于酚类化合物, 离子态酚对分子态酚的毒性是没有贡献的[31];而多数学者认为离子态对毒性有贡献, 只是毒性较低。ZHAO等[32]研究安息香酸(pKa=4.19) 对大型溞毒性时发现, 离子形态和分子形态化合物对毒性都有贡献, 只是贡献程度有差别。笔者认为, 离子态对毒性的贡献可能因化合物而异, 但离子态污染物对毒性有一定作用。
3.2 pH值对IOCs生物富集的影响相比于生物毒性, 生物富集更强调污染物在生物体内的存在形式、存在量及存在活性, 生物富集因子(bioaccumulation factors, BCF, Fb, c)常被研究者用于研究污染物在生物体内的富集量。通常而言, BCF为污染物在生物体内富集量与污染物在环境中存在量的比值。对于IOCs而言, BCF主要受pH的影响, 但pH对生物富集的影响较毒性小。NICHOLS等[33]通过研究在pH值为6.7、7.7和8.7环境下苯海拉明(pKa=9.0) 对鱼的生物富集影响, 发现BCF和血液-水分配系数随着pH值增大呈非线性增长关系。ANSKJAER等[34]研究磺胺嘧啶(pKa=6.48) 对大型溞24和48 h急性毒性发现, 随着pH值的增大, 其EC50(24 h)从54.2 mg·L-1(pH值为6.0) 增加到798 mg·L-1(pH值为8.5), 但BCF随着pH值的增加并没有发生明显变化, 而且, 随着时间的增加, 48 h EC50之间的差异减小。因此推测, 虽然离子形式穿透较慢, 但随着时间的增加, 离子态污染物可以缓慢透过生物膜从而达到靶标位点或在生物体内富集。
在水环境中, 一般直接测定水中污染物含量, 仅有部分可溶性有机质可能吸附IOCs, 而且吸附能力较弱, 生物体对IOCs吸收的差异是影响IOCs生物有效性的关键过程。由于污染物进入生物体内后, 只有到达靶作用位点的那部分才被认为是毒理学有效的, 因此生物有效性还取决于毒代动力学(toxic kinetics)过程[35]。对于同一种生物而言, 其具有基本一致的生理结构, 生物体外IOCs的自由溶解浓度毒性以及穿透生物膜的能力取决于环境中pH值大小。
当环境中污染物浓度相同时, 中性分子形式相对于离子形式更有利于穿透生物膜到达靶标位点。化合物一旦进入生物膜内, 外界环境pH值变化将不影响生物体内对于污染物的吸收, 因此由体内IOCs浓度能够推算出靶标浓度, 从而预测其毒性[36]。因此,pH对IOCs毒性的影响可以近似地利用pH对IOCs富集的影响来表征。
4 IOCs生物有效性评价方法 4.1 生物检测法评价生物有效性最直接的方法是生物富集性检测或毒性检测, 用生物评价法检测生物有效性可分为动物法、植物法和微生物法等。研究人员采用生物检测法时, 要考虑生物特异性, 如觅食方式、生活习性、体内脂肪含量、生物代谢等控制着污染物的毒性或生物富集过程。一般来说, 根据暴露途径(生物体获取污染物的方式, 如表皮吸附、鳃或肺呼吸、肠胃消化吸收等)对生物进行分类筛选, 从而选择最恰当的生物受体进行试验。
采用活体动物时, 如以消化道作为主要吸收模式的生物——底栖动物、土壤动物等, 蚯蚓(Eisenia foetida)[37]、弹尾虫(Folsomia candida)等已被经济发展与合作组织(Organization for Economic Co-operation and Development, OECD)和国际标准化组织(International Organization for Standardization, ISO)推荐作为毒性测试生物[38-39], 但需要考虑到消化(异化)过程以使摄食暴露途径区别于膜与水相的直接接触暴露(一些结合态化合物可能会在肠腔内解吸)[40]。WESTON等[41]研究证实底栖动物中与沉积物结合的污染物在经过肠道时的增溶程度对富集起决定性作用, 被溶解的PAHs结合态大部分可以跨肠膜被吸收, 甚至可达100%。PIGNATELLO等[42]通过对温血动物研究发现, 当其摄食颗粒物时, 温血动物肠道内部的温度通常比所摄入的土壤高, 此时会导致污染物在黏性介质如天然有机质(natural organic matter, NOM)上的扩散和解吸。NACSA等[43]研究发现氯雷他定在生物体内的有效性取决于受试生物胃肠内部的pH值, 随着pH值的增大, 其溶解度减小并在pH值为3时保持恒定值, 但用环糊精包裹药物后再注入生物体内, 可使其溶解性不受pH的影响。当采用以鳃或表皮为主要吸收模式的生物时, 如鱼类等, 应主要考虑到生物表皮特性, 从而判断其吸收污染物时是否会改变其生物有效性。ERICKSON等[44]研究发现鱼鳃的分泌物能改变其表面pH值, 使鱼鳃表面水环境中IOCs中性分子与离子的比例发生变化, 进而改变污染物生物有效性。
与动物相比, 植物对IOCs的吸收相对简单, 污染物主要通过植物根部与土壤溶液进行离子交换从而进入皮层内部, 通过内部空间进入木质部。CHAMBERLAIN等[45]比较吸收时间和pH两种因素下植物嫩茎和根系对十二环吗啉和十三环吗啉(pKa均约为7.5) 的吸收发现, pH值为8时植物嫩茎对2种化合物的吸收量均大于pH值为5时的吸收量, 而且24 h实验结果与48 h实验结果非常相似。但需要考虑植物根系分泌的一些物质可能影响根际pH, 如小叶羽扇豆根际分泌物能使根际环境pH值下降2个单位[46], 并考虑土壤中存在的小分子有机酸与土壤中黏土矿物和有机组分发生作用而影响有机污染物的转化[47], 从而进一步影响IOCs生物有效性。
微生物也可以用于评价IOCs的生物有效性, 如GODSKESEN等[48]发现老化和田间土壤中残留化合物的生物有效性都可以用矿化细菌来评价。大多数细菌能控制体内pH值的范围, 但不同细菌的控制能力不同, 其吸收存在差异, 例如大肠杆菌能控制内部pH值为7.6~7.8[49], 而乙酸菌热醋酸梭状芽胞杆菌(Clostridium thermoaceticum)内部pH值可为5.7~7.3[50]。对于能够较好控制内部pH值基本不变的细菌, 由于内外pH值的差异较大, 外部pH能显著影响其对IOCs的吸收。
综上可知, 生物体对IOCs的吸收不但受环境介质中pH的影响, 更取决于受试生物体内pH; 对于不同吸收模式的生物体而言, 需要研究其在吸收过程中所经历的场所, 如消化道、鳃、根尖等, 后续研究工作应探讨污染物在生物体内传递过程中产生了何种变化。因此, 不同生物内环境pH条件下对IOCs生物有效性的评价结果应该同时取决于药物和生物体的特性。
4.2 模型预测法目前, 研究者结合污染物的物理化学性质和生态参数等, 将模型方法应用于生物有效性评价, 从而判断污染物的生物有效性[40]。就目前的研究而言, 针对可电离化合物生物有效性的模型预测研究较少, 且实验过程较为繁琐, 需要进行基于生物可利用量及其所带来的环境影响的模型研究。
4.2.1 脂水分配模型脂水分配模型基于污染物在生物体内脂质与水层之间的不同分配。GAO等[51]研究植物在吸收土壤和水中污染物时, 其吸收的污染物含量与植物根系脂质含量存在正相关关系。该理论通常用于计算IOCs处于不同环境介质中时的分配比例, 如正辛醇-水分配系数(Kow)经常用于检测有机化合物在水和正辛醇中的分配系数不同从而判断其生物富集量大小。KISHINO等[52]研究发现可离子化有机污染物在生物体内和介质之间的分配与正辛醇-水和庚烷-水分配存在比例关系, 生物富集比率(bioconcentration ratio, BCR)可以通过Kow进行计算。弱酸(如五氯苯酚、二硝基邻甲酚等)的Kow和生物富集系数会随着pH值的降低而增大, 但对弱碱(如氯苯胺、甲基苯胺等)而言, pH值的增大会导致其Kow值和生物富集系数增大[53-54]。但相比于lg Kow, FU等[55]通过比较73种酸性化合物和65种碱性化合物, 发现lg D(脂溶性对数)更符合IOCs受pH影响时所表现出的在不同两相中溶解度的差异。
近年来, 采用磷脂膜-水分配系数(Km, w)探究IOCs生物有效性逐渐受到关注, 可将其作为检测非均质物质的参数[56], 可以较好地检测基线毒性[57]。由于用生物膜直接模拟较为复杂, 因此可用脂水分配系数(Klip, w)代替Km, w进行检测[58]。BITTERMANN等[59]通过比较3种模型预测离子化合物Km,w发现, 采用Kow参数模拟时, 有机酸〔均方根误差(RMSE)为0.79〕符合能力比有机碱(RMSE为1.14) 更强。采用单一多参数线性自由能方程(PP-LFER)模型时, 可以较好地模拟中性化合物的分配, 但对于可电离化合物而言, 相关性较差(阴离子和阳离子RMSE分别为1.26和1.12), 其主要原因可能是2种离子在膜上的吸附能力不同。微细胞导体筛选模型(Conductor-like Screening Model for MICells, COSMOmic)被证明是检测离子化有机物分配的最好模型(阴离子和阳离子RMSE分别为0.66和0.71)。
4.2.2 离子俘获模型离子俘获模型(ion-trapped model)是基于脂水分配模型设定的一种模型, 其通过假设只有中性分子才能穿透生物膜的原则来判断IOCs在不同存在形式下对生物体有无毒性。NEUWOEHNER等[60]研究5种碱性化合物在不同pH条件下的毒性以及在细胞质内的存在形式,发现脂肪胺在藻类中的毒性主要由细胞质内pH决定, 并非外界环境pH所导致。与此同时, 当外界环境pH和物质pKa关系为pH pKa-2时, IOCs可以只根据细胞质内pH而改变形态,从而完全不受细胞膜外pH的影响。因此, 基于这一原则可以发现在不同环境中生物体对于IOCs的吸收也是不同的, 如在药物代谢动力学中, 也存在离子俘获(又名离子障)现象。该现象的特点为“酸酸少易, 酸碱多难”, 即弱酸性药物在酸性体液中解离少, 容易透过细胞膜; 而弱酸性药物在碱性体液中解离多, 很难透过细胞膜。TRAPP[61]发现弱酸性化合物(pKa为2~6) 在酸性土壤中更容易被植物叶片和果实吸收, 而弱碱性化合物(pKa为6~10) 在碱性土壤中更易被植物吸收。
4.2.3 生物配体模型生物配体模型(BLM)在环境监测中一般用于监测重金属生物有效性, 其将生物受体位点作为生物配体, 利用水环境中特定的水质参数进行检测, 同时考虑在不同环境下重金属的有效性[62], 从而避免利用环境中重金属总浓度来评价生物有效性时所带来的不准确。另外, 利用BLM时需考虑重金属不同存在形态对生物所产生的不同毒性。如KAREL等[63]利用BLM预测铜对大型溞急性毒性时, 认为铜的毒性并不是仅仅由铜离子浓度决定的, 其还取决于环境中pH值以及铜离子与其他离子在水-生物体界面所产生的离子竞争, 从而改变其生物有效性, pH值越高, 铜离子毒性越强。从这一原则来说, 该模型可以模拟环境中可电离化合物的生物有效性, 即在不同pH环境下重金属所产生的形态不同, 从而导致其生物有效性差异。但CHAD等[64]认为, BLM是以总溶解性金属为基础的, 没有考虑环境中固体悬浮物参数, 预测的自由离子浓度可能要高于实测值, 其主要原因可能是固体悬浮物产生了吸附作用, 而且环境中所存在的不同有机质类型也可能存在差异, 有待于进一步研究。
4.2.4 平衡分配理论平衡分配理论(equilibrium partition theory, EPT)最初由Shea提出, Ditoro等应用了该理论, 认为底栖生物与陆生生物在吸收孔隙水中有机物时, 生物体内有机物含量与水环境中有机物含量形成平衡状态[65], 其主要基于环境中疏水性化合物在生物体内的被动扩散从而达到平衡的机理。SIJM等[66]假设疏水性化合物的吸收速率受其穿透水相扩散层的阻力控制, 建立了一个鱼类吸收模型来评价生物有效性, 计算结果与实验数据有很好的一致性。
但IOCs更多地是亲水性的, 而且其受到环境pH的影响时所产生的扩散与疏水性有机物的被动扩散有很大差别。但可以基于这个原理进行分析, 如利用离子化合物和中性化合物不同的热力学性质来判断可电离化合物的分配[67]。叶常明等[68]由热力学平衡基本原理导出IOCs在沉积物和水相中的分配系数, 以苯酚、邻氯酚、2, 4-二氯酚和五氯酚等有机酸, 以及以苯胺为代表的有机碱作为实验材料研究发现, 相比于有机碱其所推导的理论模型更适用于有机酸, pH是影响其在不同环境中分配的主要因素。离子化有机污染物在沉积物和水相中的分配不仅取决于化合物的pKa, 还取决于环境介质的pH。更重要的是平衡分配理论没有考虑生物体对孔隙水中IOCs不同存在形式本身吸收的差异, 可能不适合IOCs生物有效性预测。
化学模型法主要通过用化学方式模拟污染物在不同介质层面上的分配与吸收, 可以在一定程度上预测生物有效性。但化学模型预测只是建立在假设上, 一方面其主要以经验数据作为判断依据, 并没有考虑生物体内的消化影响, 以及胃肠吸收能力不同等因素。如SCHEBB等[69]在实验中测得三氯卡班(TCC)在青鳉体内的生物富集系数(lg Fb, c)为2.86, 远远低于根据Kow值推算出的生物富集系数。因此, 现有的化学模型预测方法只能在一定程度上作为评价生物有效性的标准。
4.3 化学分析检测法 4.3.1 溶剂萃取法传统的提取方法主要通过化学溶剂在特定条件下对环境中污染物进行提取, 而以往评价有机污染物的环境风险往往是根据其在环境中的“总量”, 因此常常采用耗竭提取法, 如用索氏提取法[70]提取土壤中有机污染物。随着研究的深入, 研究者发现有机污染物总量与其生物有效性相关性较差, 常常夸大了有机污染物的环境风险[71]。因此, 温和有机溶剂提取[72-73]、超临界流体提取[74]和环糊精溶液提取[75]等方法被应用于提取生物有效部分。然而, 这些方法大多缺少理论支撑, 仅在一定程度上能提高生物有效性评价效果, 且关于有效浓度IOCs的提取报道鲜见。
4.3.2 仿生萃取法KNEZOVICH等[76]根据平衡分配理论, 提出用孔隙水浓度作为检测土壤中化合物生物有效性的依据, 并阐述孔隙水中浓度和沉积物中生物有机碳含量呈负相关。但由于孔隙水中存在可溶性有机物, 使得溶解在孔隙水中的污染物可能被吸附, 用孔隙水中污染物总浓度来表征也会高估生物有效性[77]。进一步研究证明自由溶解态浓度与生物毒性(或富集)具有更好的相关性, 自由溶解态浓度能够较好地用于评估生物有效性[78-79]。因此, 土壤或底泥孔隙水中污染物(自由溶解)浓度是用于土壤中污染物生物有效性和环境风险评估的重要参数[80]。
目前, 环境中污染物自由溶解态浓度测定的主要原理为模拟生物膜对物质的吸收, 如基质固相微萃取(matrix solid-phase microextraction, matrix-SPME)[81]、三油酸甘油脂-醋酸纤维素复合膜(triolein-embedded cellulose acetate membrane, TECAM)[82]、液相微萃取技术(liqid-phase microextraction, LPME)[83]、半渗透膜采样技术(semipermeable membrane device, SPMD)[84]等。SPME已经广泛地应用于农药残留检测和生物有效性检测[85], 其主要原理是将少量固定于固体支撑物上的萃取相暴露于样品体系中一段时间, 待达到平衡后直接进行脱附、分析[86]。影响SPME分析不同种类化合物的主要因素是其上吸附的涂层不同。目前,常用的商品化纤维头涂层只有7种, 包括PDMS、PA这2种液态聚合物涂层, 以及PDMS/DVB、PDMS/CAR、CW/DVB、CW/TPR和DVB/CAR/PDMS共5种固态多孔涂层, 除PA液态聚合物涂层外, 其余6种涂层均为非极性物质[86]。因此, 是否能够测定土壤中IOCs含量主要取决于涂层类型。HAFTKA等[87]已经成功应用以聚丙烯酸酯(polyacrylate-coated)为涂层的固相微萃取方法检测溶解性有机碳(dissolved organic carbon, DOC)对极性和离子有机污染物的吸附, 因此可以通过提取土壤中孔隙水进行测定。但天然环境中孔隙水中溶解性有机质(dissolved organic matter, DOM)对IOCs的吸附是否有影响还鲜见报道, 应做进一步研究。
相比于SPME, LPME技术更加简便, 更加快速, 其基本原理与SPME类似, 主要通过物质在两相中的分配系数不同从而测定物质含量[88]。目前, 应用较广泛的多为基于中空纤维的液相微萃取方法。为提高检测限, 传统分析方法通常追求最大的富集倍数。对于酸性分析物, 样品水溶液的pH值要低以降低分析物在样品中的溶解度, 而受体溶液的pH值要高以增大分析物在受体溶液中的溶解度;对于碱性分析物则正好相反[89]。当LPME被用于生物有效性评价时, 样品溶液pH保持与生物体生长环境一致, 以便模拟生物体对IOCs的吸收。根据纤维内腔的受体溶液与纤维孔中溶液是否一致, 中空纤维液相微萃取可分为两相和三相萃取2种。对于可离子化的样品测定, 为了提高灵敏度, 一般采用液-液-液三相萃取, 该模式与IOCs穿过生物膜进入生物体类似, 有望用来评价IOCs生物有效性。LIU等[90]利用中空纤维模拟水中大型溞对磺胺嘧啶的生物吸收, 发现利用中空纤维管中检测浓度和名义浓度分别计算磺胺嘧啶对大型溞的EC50时, 前者能够更为准确地评估磺胺嘧啶对大型溞的生物有效性。
SPMD主要利用化学膜扩散原理, 使分析物质通过被动扩散方式从外界环境中进入膜内从而达到分配平衡[91], 其装置组成利用化学膜扩散原理, 将一高纯度类脂物密封于半透膜袋(如聚乙烯膜)中组成SPMD。相对而言, 三油酸甘油酯(troilen)由于其易于合成纯化, 是目前用于SPMD的最佳类脂物[92], 如采用troilen半渗透膜测定环境中多氯联苯(PCBs)[93]以及测定水体中痕量有机氯农药[94]。TECAM原理与SPMD基本相同, 但TECAM主要以troilen结合醋酸纤维复合膜构成镶嵌结构, 结合更加紧密, 接触面积更大[95]。KE等[96]研究表明TECAM可以迅速而有效地富集水中自由溶解态疏水性有机物。但对于离子化有机物, 其脂溶性较差, 且荷电离子通过膜的质量传输阻力较大[92], 因此并不适用于IOCs生物有效性的检测。
5 总结与展望相对于传统中性有机污染物, 可电离有机污染物与重金属类似, 易受到环境因素影响从而改变其活性, 而影响IOCs存在形式的因素主要为环境pH。对于外环境而言, pH影响物理化学吸附、生物膜外吸收等; 对于内环境而言, 由于生物本身的特异性, 污染物进入生物体内存在不同的生物活性, 导致生物吸收效率存在较大差异。因此, 今后在进行IOCs风险评估时, 需要同时考虑其物理化学吸附及生物体对可电离有机污染物吸收2个过程对其生物有效性的影响。更要注意生物的特异性, 特别是生物体消化道或呼吸道pH对生物有效性的影响。在评估IOCs生物有效性时, 若采用模型预测法, 离子俘获模型是预测可电离化合物生物有效性的主要模型, 其他模型能否评价IOCs生物有效性有待进一步研究。从现有的评价方法来看, 被动取样技术在理论上能较好地评价IOCs生物有效性, 液相微萃取尤其是三相中空纤维液相微萃取更适合分析IOCs, 有望成为评价IOCs生物有效性的主要方法。
| [1] |
KAH M, BROWN C D. Adsorption of Ionisable Pesticides in Soils[J]. Reviews of Environmental Contamination and Toxicology, 2006, 188: 149-217. (  0) 0) |
| [2] |
FRANCO A, FERRANTI A, DAVIDSEN C, et al. An Unexpected Challenge:Ionizable Compounds in the Reach Chemical Space[J]. The International Journal of Life Cycle Assessment, 2010, 15(4): 321-325. DOI:10.1007/s11367-010-0165-6 (  0) 0) |
| [3] |
AKKANEN J, PENTTINEN S, HAITZER M, et al. Bioavailability of Atrazine, Pyrene and Benzo[a]pyrene in European River Waters[J]. Chemosphere, 2001, 45(4/5): 453-462. (  0) 0) |
| [4] |
GOBAS F, ZHANG X.Interactions of Organic Chemicals With Particulate and Dissolved Organic Matter in the Aquatic Environment[M]//Bioavailability:Physical, Chemical, and Biological Interactions.Boca Raton, USA:Lewis Publishers, 1994.
(  0) 0) |
| [5] |
梅宁, 尹凤, 陆虹涛. 湿度变化对气体污染物扩散影响的研究[J]. 中国海洋大学学报(自然科学版), 2006, 36(6): 987-990. MEI Ning, YIN Feng, LU Hong-tao. The Effects of Relative Humidity on the Atmospheric Dispersion of Air Pollutants[J]. Periodical of Ocean University of China(Natural Science Edition), 2006, 36(6): 987-990. (  0) 0) |
| [6] |
吴小毛. 土壤中农药残留对蚯蚓的生物有效性[D]. 杭州: 浙江大学, 2005. WU Xiao-mao.Bioavailability of Pesticide Residue in Soil to Earthworms[D]. Hangzhou:Zhejiang University, 2005. (  0) 0) |
| [7] |
胡霞林, 刘景富, 卢士燕, 等. 环境污染物的自由溶解态浓度与生物有效性[J]. 化学进展, 2009, 21(2): 514-523. HU Xia-lin, LIU Jing-fu, LU Shi-yan, et al. Freely Dissolved Concentration and Bioavailability of Environmental Pollutants[J]. Progress in Chemistry, 2009, 21(2): 514-523. (  0) 0) |
| [8] |
KATAYAMA A, BHULA R, BURNS G R, et al.Bioavailability of Xenobiotics in the Soil Environment[M]//Reviews of Environmental Contamination and Toxicology.New York, USA:Springer, 2010:1-86.
(  0) 0) |
| [9] |
LANDRUM P F, EADIE B J, FAUST W R. Toxicokinetics and Toxicity of a Mixture of Sediment-Associated Polycyclic Aromatic Hydrocarbons to the Amphipod Diporeia sp[J]. Environmental Toxicology and Chemistry, 1991, 10(1): 35-46. (  0) 0) |
| [10] |
SEMPLE K T, DOICK K J, JONES K C, et al. Defining Bioavailability and Bioaccessibility of Contaminated Soil and Sediment Is Complicated[J]. Environmental Science & Technology, 2004, 38(12): 228A-231A. (  0) 0) |
| [11] |
SCHWARZENBACH R P, GSCHWEND P M, IMBODEN D M.Environmental Organic Chemistry[M]. 2nd ed.New Jersey, USA:John Wiley & Sons Inc., 2003.
(  0) 0) |
| [12] |
BERGLÖF T, DUNG T V, KYLIN H, et al. Carbendazim Sorption-Desorption in Vietnamese Soils[J]. Chemosphere, 2002, 48(3): 267-273. DOI:10.1016/S0045-6535(02)00096-6 (  0) 0) |
| [13] |
CALVET R. Adsorption of Organic-Chemicals in Soils[J]. Environmental Health Perspectives, 1989, 83: 145-177. DOI:10.1289/ehp.8983145 (  0) 0) |
| [14] |
FRANCO A, FU W J, TRAPP S. Influence of Soil pH on the Sorption of Ionizable Chemicals:Modeling Advances[J]. Environmental Toxicology and Chemistry, 2009, 28(3): 458-464. DOI:10.1897/08-178.1 (  0) 0) |
| [15] |
LEE L S, RAO P S C, NKEDIKIZZA P, et al. Influence of Solvent and Sorbent Characteristics on Distribution of Pentachlorophenol in Octanol-Water and Soil-Water Systems[J]. Environmental Science & Technology, 1990, 24(5): 654-661. (  0) 0) |
| [16] |
张伟, 王进军. 溶液pH值及模拟酸雨对两种磺酰脲类除草剂在土壤中行为的影响[J]. 应用生态学报, 2007, 3(6): 613-619. ZHANG Wei, WANG Jin-jun. Effects of Solution pH and Simulated Acid Rain on the Behavior of Two Sulfonylurea Herbicides in Soil[J]. Chinese Journal of Applied Ecology, 2007, 3(6): 613-619. (  0) 0) |
| [17] |
HYUN S, LEE L S, RAO P S C. Significance of Anion Exchange in Pentachlorophenol Sorption by Variable-Charge Soils[J]. Journal of Environmental Quality, 2003, 32(3): 966-976. DOI:10.2134/jeq2003.9660 (  0) 0) |
| [18] |
LIU K L, CAO Z Y, PAN X, et al. Using in Situ Pore Water Concentrations to Estimate the Phytotoxicity of Nicosulfuron in Soils to Corn (Zea mays L.)[J]. Environmental Toxicology and Chemistry, 2012, 31(8): 1705-1711. DOI:10.1002/etc.v31.8 (  0) 0) |
| [19] |
SUN H W, WANG F, FENG B T, et al. Sorption of Ionizable Organic Amines on Soil and Their Effects on Phenanthrene Sorption[J]. Water, Air, & Soil Pollution, 2015, 226(8): 257. (  0) 0) |
| [20] |
FRUHSTORFER P, SCHNEIDER R J, WEIL L, et al. Factors Influencing the Adsorption of Atrazine on Montmorillonitic and Kaolinitic Clays[J]. Science of the Total Environment, 1993, 138(1/2/3): 317-328. (  0) 0) |
| [21] |
DE JONGE H, DE JONGE L W, JACOBSON O H, et al. Glyphosate Sorption in Soils of Different pH and Phosphorus Content[J]. Soil Science, 2001, 166(4): 230-238. DOI:10.1097/00010694-200104000-00002 (  0) 0) |
| [22] |
KÖNEMANN H, MUSCH A. Quantitative Structure-Activity Relationships in Fish Toxicity Studies Part 2:The Influence of pH on the QSAR of Chlorophenols[J]. Toxicology, 1981, 19(3): 223-228. DOI:10.1016/0300-483X(81)90131-1 (  0) 0) |
| [23] |
李建华, 阚海峰, 毛亮, 等. pH值和硬度对两种氯酚类化合物对大型溞急性毒性的影响[J]. 中国环境科学, 2013, 33(12): 2251-2256. LI Jian-hua, KAN Hai-feng, MAO Liang, et al. Effects of pH and Water Hardness on the Acute Toxicity of Two Chlorophenols to Daphnia magna[J]. China Environmental Science, 2013, 33(12): 2251-2256. (  0) 0) |
| [24] |
INOUE J, CHAMBERLAIN K, BROMILOW R H. Physicochemical Factors Affecting the Uptake by Roots and Translocation to Shoots of Amine Bases in Barley[J]. Pesticide Science, 1998, 54(1): 8-21. DOI:10.1002/(SICI)1096-9063(199809)54:1<>1.0.CO;2-U (  0) 0) |
| [25] |
RENDAL C, KUSK K O, TRAPP S. The Effect of pH on the Uptake and Toxicity of the Bivalent Weak Base Chloroquine Tested on Salix viminalis and Daphnia magna[J]. Environmental Toxicology and Chemistry, 2011, 30(2): 354-359. DOI:10.1002/etc.v30.2 (  0) 0) |
| [26] |
COLLINS C, FRYER M, GROSSO A. Plant Uptake of Non-Ionic Organic Chemicals[J]. Environmental Science & Technology, 2006, 40(1): 45-52. (  0) 0) |
| [27] |
ZHANG M, ZHU L. Sorption of Polycyclic Aromatic Hydrocarbons to Carbohydrates and Lipids of Ryegrass Root and Implications for a Sorption Prediction Model[J]. Environmental Science & Technology, 2009, 43(8): 2740-2745. (  0) 0) |
| [28] |
RENDAL C.The Effect of pH on the Bioconcentration and Toxicity of Weak Organic Electrolytes[D]. Kgs Lyngby, Denmark:DTU Environment, 2013.
(  0) 0) |
| [29] |
BOSTRÖM M L, BERGLUND O. Influence of pH-Dependent Aquatic Toxicity of Ionizable Pharmaceuticals on Risk Assessments Over Environmental pH Ranges[J]. Water Research, 2015, 72: 154-161. DOI:10.1016/j.watres.2014.08.040 (  0) 0) |
| [30] |
RENDAL C, KUSK K O, TRAPP S. Optimal Choice of pH for Toxicity and Bioaccumulation Studies of Ionizing Organic Chemicals[J]. Environmental Toxicology and Chemistry, 2011, 30(11): 2395-2406. DOI:10.1002/etc.v30.11 (  0) 0) |
| [31] |
CRONIN M T D, ZHAO Y H, YU R L. pH-Dependence and QSAR Analysis of the Toxicity of Phenols and Anilines to Daphnia magna[J]. Environmental Toxicology, 2000, 15(2): 140-148. DOI:10.1002/(ISSN)1522-7278 (  0) 0) |
| [32] |
ZHAO Y H, JI G D, CRONIN M T D, et al. QSAR Study of the Toxicity of Benzoic Acids to Vibrio fischeri, Daphnia magna and Carp[J]. Science of the Total Environment, 1998, 216(3): 205-215. DOI:10.1016/S0048-9697(98)00157-0 (  0) 0) |
| [33] |
NICHOLS J W, DU B, BERNINGER J P, et al. Observed and Modeled Effects of pH on Bioconcentration of Diphenhydramine, a Weakly Basic Pharmaceutical, in Fathead Minnows[J]. Environmental Toxicology and Chemistry, 2015, 34(6): 1425-1435. DOI:10.1002/etc.2948 (  0) 0) |
| [34] |
ANSKJAER G G, RENDAL C, KUSK K O. Effect of pH on the Toxicity and Bioconcentration of Sulfadiazine on Daphnia magna[J]. Chemosphere, 2013, 91(8): 1183-1188. DOI:10.1016/j.chemosphere.2013.01.029 (  0) 0) |
| [35] |
EHLERS L J, LUTHY R G. Contaminant Bioavailability in Soil and Sediment[J]. Environmental Science & Technology, 2003, 37(15): 295-302. (  0) 0) |
| [36] |
ESCHER B, HERMENS J L. Internal Exposure:Linking Bioavailability to Effect[J]. Environmental Science & Technology, 2004, 38(23): 455-462. (  0) 0) |
| [37] |
LANNO R, WELLS J, CONDER J, et al. The Bioavailability of Chemicals in Soil for Earthworms[J]. Ecotoxicology and Environmental Safety, 2004, 57(1): 39-47. DOI:10.1016/j.ecoenv.2003.08.014 (  0) 0) |
| [38] |
OECD.Guideline for Testing of Chemicals-Earthworm Acute Toxicity Test.No.207[S].
(  0) 0) |
| [39] |
ISO/FDIS.Soil Quality:Inhibition of Reproduction of Collembola (Folsomiacandida) by Soil Pollutants No. 11267[S].
(  0) 0) |
| [40] |
陈珊, 许宜平, 王子健. 有机污染物生物有效性的评价方法[J]. 环境化学, 2011, 30(1): 158-164. CHEN Shan, XU Yi-ping, WANG Zi-jian. Methods for Evaluating the Bioavailability of Organic Contaminants in Environments[J]. Environmental Chemistry, 2011, 30(1): 158-164. (  0) 0) |
| [41] |
WESTON D P, MAYER L M. Comparison of in Vitro Digestive Fluide Etraction and Traditional in Vivo Approaches as Measures of Polycyclic Aromatic Hydrocarbon Bioavailability From Sediments[J]. Environmental Toxicology and Chemistry, 1998, 17(5): 830-840. DOI:10.1897/1551-5028(1998)017<0830:COIVDF>2.3.CO;2 (  0) 0) |
| [42] |
PIGNATELLO J J, XING B. Mechanisms of Slow Sorption of Organic Chemicals to Natural Particles[J]. Environmental Science & Technology, 1996, 30(1): 1-11. (  0) 0) |
| [43] |
NACSA A, BERKESI O, SZABÓ-RÉVÉSZ P, et al. Achievement of pH-Independence of Poorly-Soluble, Ionizable Ioratadine by Inclusion Complex Formation With Dimethyl-β-Cyclodextrin[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2009, 64(3): 249-254. (  0) 0) |
| [44] |
ERICKSON R J, MCKIM J M, LIEN G J, et al. Uptake and Elimination of Ionizable Organic Chemicals at Fish Gills:Ⅱ.Observed and Predicted Effects of pH, Alkalinity, and Chemical Propertiesv[J]. Environmental Toxicology and Chemistry, 2006, 25(6): 1522-1532. DOI:10.1897/05-359R.1 (  0) 0) |
| [45] |
CHAMBERLAIN K, PATEL S, BROMILOW R H. Uptake by Roots and Translocation to Shoots of Two Morpholine Fungicides in Barley[J]. Pesticide Science, 1998, 54(1): 1-7. DOI:10.1002/(SICI)1096-9063(199809)54:1<>1.0.CO;2-U (  0) 0) |
| [46] |
HINSINGER P, GILKES R J. Root-Induced Dissolution of Phosphate Rock in the Rhizosphere of Lupins Grown in Alkaline Soil[J]. Soil Research, 1995, 33(3): 477-489. DOI:10.1071/SR9950477 (  0) 0) |
| [47] |
刘永红, 马舒威, 岳霞丽, 等. 土壤环境中的小分子有机酸及其环境效应[J]. 华中农业大学学报, 2014, 33(2): 133-138. LIU Yong-hong, MA Shu-wei, YUE Xia-li, et al. Low Molecular Weight Organic Acids in Soils and Its Environmental Effects[J]. Journal of Huazhong Agricultural University, 2014, 33(2): 133-138. (  0) 0) |
| [48] |
GODSKESEN B, HOLM P E, JACOBSEN O S, et al. Aging of Triazine Amine in Soils Demonstrated Through Sorption, Desorption, and Bioavailability Measurements[J]. Environmental Toxicology and Chemistry, 2005, 24(3): 510-516. DOI:10.1897/04-041R.1 (  0) 0) |
| [49] |
ZILBERSTEIN D, AGMON V, SCHULDINER S, et al. Escherichia coli Intracellular pH, Membrane Potential, and Cell Growth[J]. Journal of Bacteriology, 1984, 158(1): 246-252. (  0) 0) |
| [50] |
BEALES N. Adaptation of Microorganisms to Cold Temperatures, Weak Acid Preservatives, Low pH, and Osmotic Stress:A Review[J]. Comprehensive Reviews in Food Science and Food Safety, 2004, 3(1): 1-20. DOI:10.1111/crfs.2004.3.issue-1 (  0) 0) |
| [51] |
GAO Y Z, ZHU L Z, LING W T. Application of the Partition-Limited Model for Plant Uptake of Organic Chemicals From Soil and Water[J]. Science of the Total Environment, 2005, 336(1/3): 171-182. (  0) 0) |
| [52] |
KISHINO T, KOBAYASHI K. Relation Between Toxicity and Accumulation of Chlorophenols at Various pH, and Their Absorption Mechanism in Fish[J]. Water Research, 1995, 29(2): 431-422. DOI:10.1016/0043-1354(94)00189-E (  0) 0) |
| [53] |
ARNOLD C G, WEIDENHAUPT A, DAVID M M. Aqueous Speciation and Octanol-Water Partitioning of Tributyl-and Triphenyltin:Effect of pH and Ion Composition[J]. Environmental Science & Technology, 1997, 31(9): 2596-2602. (  0) 0) |
| [54] |
JOHNSON C A, WESTALL J C. Effect of pH and Potassium Chloride Concentration on the Octanol-Water Distribution of Methylanilines[J]. Environmental Science & Technology, 1990, 24(12): 1869-1875. (  0) 0) |
| [55] |
FU W, FRANCO A, TRAPP S. Methods for Estimating the Bioconcentration Factor of Ionizable Organic Chemicals[J]. Environmental Toxicology and Chemistry, 2009, 28(7): 1372-1379. DOI:10.1897/08-233.1 (  0) 0) |
| [56] |
ARMITAGE J M, ARNOT J A, WANIA F, et al. Development and Evaluation of a Mechanistic Bioconcentration Model for Ionogenic Organic Chemicals in Fish[J]. Environmental Toxicology and Chemistry, 2013, 32(1): 115-128. DOI:10.1002/etc.2020 (  0) 0) |
| [57] |
VAES W H J, RAMOS E U, VERHAAR H J M, et al. Acute Toxicity of Nonpolar Versus Polar Narcosis:Is There a Difference?[J]. Environmental Toxicology and Chemistry, 1998, 17(5): 1380-1384. (  0) 0) |
| [58] |
ESCHER B I, SCHWARZENBACH R P. Partitioning of Substituted Phenols in Liposome-Water, Biomembrane-Water, and Octanol-Water Systems[J]. Environmental Science & Technology, 1995, 30(1): 260-270. (  0) 0) |
| [59] |
BITTERMANN K, SPYCHER S, GOSS K U. Comparison of Different Models Predicting the Phospholipid-Membrane Water Partition Coefficients of Charged Compounds[J]. Chemosphere, 2016, 144: 382-391. DOI:10.1016/j.chemosphere.2015.08.065 (  0) 0) |
| [60] |
NEUWOEHNER J, ESCHER B I. The pH-Dependent Toxicity of Basic Pharmaceuticals in the Green Algae Scenedesmus vacuolatus Can Be Explained With a Toxicokinetic Ion-Trapping Model[J]. Aquatic Toxicology, 2011, 101(1): 266-275. DOI:10.1016/j.aquatox.2010.10.008 (  0) 0) |
| [61] |
TRAAP S. Bioaccumulation of Polar and Ionizable Compounds in Plants[J]. Ecotoxicology Modeling, 2009, 2: 299-353. DOI:10.1007/978-1-4419-0197-2 (  0) 0) |
| [62] |
王春艳, 陈浩, 安立会, 等. BLM预测水中重金属生物有效性研究进展[J]. 环境科学与技术, 2011, 34(8): 75-80. WANG Chun-yan, CHEN Hao, AN Li-hui, et al. An Updated Review on Biotic Ligand Model in Predicting Metal Bioavailability in Surface Waters[J]. Environmental Science & Technology, 2011, 34(8): 75-80. (  0) 0) |
| [63] |
DE SCHAMPHELAERE K A C, JANSSEN C R. A Biotic Ligand Model Predicting Acute Copper Toxicity for Daphnia magna:The Effects of Calcium, Magnesium, Sodium, Potassium, and pH[J]. Environmental Science & Technology, 2002, 36(1): 48-54. (  0) 0) |
| [64] |
BOECKMAN C J B. The Effects of Temperature, Suspended Solids, and Organic Carbon on Copper Toxicity to Two Aquatic Invertebrates[J]. Water, Air, and Soil Pollution, 2006, 171(1): 185-202. (  0) 0) |
| [65] |
刘静, 王天妮, 孙金诚, 等. 土壤中多氯联苯的生物有效性预测模型研究[J]. 中国人口·资源与环境, 2011, 21(增刊2): 113-116. LIU Jing, WANG Tian-ni, SUN Jin-cheng, et al. Study on the Prediction Model of the Bioavailability of PCBs in Soil[J]. China Population, Resourses and Environment, 2011, 21(Suppl. 2): 113-116. (  0) 0) |
| [66] |
SIJM D, KRAAIJ R, BELFROID A. Bioavailability in Soil and Sediment:Exposure of Different Organisms and Approaches to Study It[J]. Environmental Pollution, 2000, 108(1): 113-119. DOI:10.1016/S0269-7491(99)00207-9 (  0) 0) |
| [67] |
INOUE J, CHAMBERLAIN K, BROMILOW R H. Physicochemical Factors Affecting the Uptake by Roots and Translocation to Shoots of Amine Bases in Barley[J]. Pesticide Science, 1998, 54(1): 8-21. DOI:10.1002/(SICI)1096-9063(199809)54:1<>1.0.CO;2-U (  0) 0) |
| [68] |
叶常明, 李铁, 雷志芳. 离子化有机污染物在沉积物和水相间的平衡分配计算[J]. 环境化学, 1998, 17(3): 205-211. YE Chang-ming, LI Tie, LEI Zhi-fang. Study on Equilibrium Partition of Ionizable Organic Contaminants Between Sediment and Water[J]. Environmental Chemistry, 1998, 17(3): 205-211. (  0) 0) |
| [69] |
SCHEBB N H, FLORES I, KUROBE T, et al. Bioconcentration, Metabolism and Excretion of Triclocarban in Larval Qurt Medaka (Oryzias latipes)[J]. Aquatic Toxicology, 2011, 105(3/4): 448-454. (  0) 0) |
| [70] |
GUERIN T F. The Extraction of Aged Polycyclic Aromatic Hydrocarbon (PAH) Residues From a Clay Soil Using Sonication and a Soxhlet Procedure:A Comparative Study[J]. Journal of Environmental Monitoring, 1999, 1(1): 63-67. DOI:10.1039/a807307d (  0) 0) |
| [71] |
BOSMA T N P, MIDDELDROP P J M, SCHRAA G, et al. Mass Transfer Limitations of Biotransformation:Quantifying Bioavailability[J]. Environmental Science & Technology, 1997, 31(1): 248-252. (  0) 0) |
| [72] |
TANG J X, AND B K A, ALEXANDER M. Chemical-Extraction Methods to Estimate Bioavailability of DDT, DDE, and DDD in Soil[J]. Environmental Science & Technology, 1999, 33(23): 4346-4351. (  0) 0) |
| [73] |
YU Y L, WU X M, LI S N, et al. Bioavailability of Butachlor and Myclobutanil Residues in Soil to Earthworms[J]. Chemosphere, 2005, 59(7): 961-967. DOI:10.1016/j.chemosphere.2004.11.009 (  0) 0) |
| [74] |
HAWTHORNE S B, AZZOLINA N A, NEUHAUSER E F, et al. Predicting Bioavailability of Sediment Polycyclic Aromatic Hydrocarbons to Hyalella azteca Using Equilibrium Partitioning, Supercritical Fluid Extraction, and Pore Water Concentrations[J]. Environmental Science & Technology, 2007, 41(17): 6297-6304. (  0) 0) |
| [75] |
REID B J, JONES K C, SEMPLE K T. Bioavailability of Persistent Organic Pollutants in Soils and Sediments:A Perspective on Mechanisms, Consequences and Assessment[J]. Environmental Pollution, 2000, 108(1): 103-112. DOI:10.1016/S0269-7491(99)00206-7 (  0) 0) |
| [76] |
KNEZOVICH J P, HARRISON F L, WILHELM R G. The Bioavailability of Sediment-Sorbed Organic Chemicals:A Review[J]. Water, Air, and Soil Pollution, 1987, 32(1): 233-245. (  0) 0) |
| [77] |
LEE S, GAN J, LIU W P, et al. Evaluation of Kd Underestimation Using Solid Phase Microextraction[J]. Environmental Science & Technology, 2003, 37(24): 5597-5602. (  0) 0) |
| [78] |
HERMENS J L M, HERINGA M B, TER LAAK T L. Bioavailability in Dose and Exposure Assessment of Organic Contaminants in (Eco) Toxicology[J]. Journal of Toxicology and Environmental Health:Part A, 2006, 70(9): 727-730. (  0) 0) |
| [79] |
SCHIRMER K, TANNEBERGER K, KRAMER N I, et al. Exploring the Role of Dosing Procedure and Chemical Properties in in Vitro, Assays Using a Fish Gill Cell Line[J]. Comparative Biochemistry and Physiology, Part A:Molecular & Integrative Physiology, 2009, 153(2): S89. (  0) 0) |
| [80] |
TER LAAK T L, AGBO S O, BARENDREGT A, et al. Freely Dissolved Concentrations of PAHs in Soil Pore Water:Measurements Via Solid-Phase Extraction and Consequences for Soil Tests[J]. Environmental Science & Technology, 2006, 40(4): 1307-1313. (  0) 0) |
| [81] |
FANG H, CHU X Q, WANG X G, et al. Using Matrix Solid-Phase Microextraction (Matrix-SPME) to Estimate Bioavailability of DDTs in Soil to Both Earthworm and Vegetables[J]. Archives of Environmental Contamination and Toxicology, 2010, 58(1): 62-70. DOI:10.1007/s00244-009-9329-4 (  0) 0) |
| [82] |
TAO Y Q, ZHANG S Z, WANG Z J, et al. Biomimetic Accumulation of PAHs From Soils by Triolein-Embedded Cellulose Acetate Membranes (TECAMs) to Estimate Their Bioavailability[J]. Water Research, 2008, 42(3): 754-762. DOI:10.1016/j.watres.2007.08.006 (  0) 0) |
| [83] |
DE BAIRROS A V, DE ALMEIDA R M, PANTALEO L, et al. Determination of Low Levels of Benzodiazepines and Their Metabolites in Urine by Hollow-Fiber Liquid-Phase Microextraction (LPME) and Gas Chromatography-Mass Spectrometry (GC-MS)[J]. Journal of Chromatography B, 2015, 975: 24-33. DOI:10.1016/j.jchromb.2014.10.040 (  0) 0) |
| [84] |
OHLENBUSCH G, KUMKE M U, FRIMMEL F H. Sorption of Phenols to Dissolved Organic Matter Investigated by Solid Phase Microextraction[J]. Science of the Total Environment, 2000, 253(1/2/3): 63-74. (  0) 0) |
| [85] |
郭彦军, 张晓伟, 徐燕. 固相微萃取技术在农药残留检测中的应用进展[J]. 现代仪器, 2009, 15(2): 15-17. GUO Yan-jun, ZHANG Xiao-wei, XU Yan. Development of SPME in the Detection of Residual Pesticides[J]. Modern Instruments, 2009, 15(2): 15-17. (  0) 0) |
| [86] |
徐刚, 史茗歌, 吴明红, 等. 固相微萃取的原理及应用[J]. 上海大学学报(自然科学版), 2013, 19(4): 368-373. XU Gang, SHI Ming-ge, WU Ming-hong, et al. Principle and Application of Solid Phase Micro-Extraction[J]. Journal of Shanghai University (Natural Science), 2013, 19(4): 368-373. (  0) 0) |
| [87] |
HAFTKA J J, SCHERPENISSE P, JONKER M T, et al. Using Polyacrylate-Coated SPME Fibers to Quantify Sorption of Polar and Ionic Organic Contaminants to Dissolved Organic Carbon[J]. Environmental Science & Technology, 2013, 47(9): 4455-4462. (  0) 0) |
| [88] |
王炎, 张永梅. 液相微萃取研究与应用[J]. 化学进展, 2009, 21(4): 696-704. WANG Yan, ZHANG Yong-mei. Advances in Liquid-Phase Microextraction[J]. Progress in Chemistry, 2009, 21(4): 696-704. (  0) 0) |
| [89] |
王春, 吴秋华, 王志, 等. 基于中空纤维的液相微萃取技术的研究进展[J]. 色谱, 2006, 24(5): 516-523. WANG Chun, WU Qiu-hua, WANG Zhi, et al. Developments of Liquid-Phase Microextraction Based on Hollow Fiber[J]. Chinese Journal of Chromatography, 2006, 24(5): 516-523. (  0) 0) |
| [90] |
LIU K L, XU S J, ZHANG M H, et al. Estimation of the Toxicity of Sulfadiazine to Daphnia magna Using Negligible Depletion Hollowfiber Liquid-Phase Microextraction Independent of Ambient pH[J]. Scientific Reports, 2016, 6: 39798. DOI:10.1038/srep39798 (  0) 0) |
| [91] |
XU Y P, WANG Z J, KE R H, et al. Accumulation of Organochlorine Pesticides From Water Using Triolein Embedded Cellulose Acetate Membranes[J]. Environmental Science & Technology, 2005, 39(4): 1152-1157. (  0) 0) |
| [92] |
范元中, 张莘民. 半渗透膜采样技术在有机污染物分析中的应用[J]. 环境科学与技术, 2004, 27(增刊1): 169-172. FAN Yuan-zhong, ZHANG Xin-min. Application of SPMD in Organic Pollutant Analysis[J]. Environmental Science & Technology, 2004, 27(Suppl. 1): 169-172. (  0) 0) |
| [93] |
王毅, 刘季昂, 马梅, 等. 利用Triolein半渗透膜采样技术测定洋河水中的优先污染物[J]. 中国环境监测, 1999, 15(1): 16-18. WANG Yi, LIU Ji-ang, MA Mei, et al. Application of Triolein-SPMD to Monitor Prior Pollutants in the Yanghe River[J]. Environmental Monitoring in China, 1999, 15(1): 16-18. (  0) 0) |
| [94] |
吕怡兵, 王子健. 三油酸酯-半渗透膜采样装置对有机氯农药的富集作用[J]. 水生生物学报, 2004, 28(5): 540-544. LÜ Yi-bing, WANG Zi-jian. Accumulation Kinetics of Organochlorinated Pesticides by Triolein-Containing Semipermeable Membrane Devices[J]. Acta Hydrobiologica Sinica, 2004, 28(5): 540-544. (  0) 0) |
| [95] |
刘开林. 土壤中可电离农药烟嘧磺隆和多菌灵生物有效性[D]. 杭州: 浙江大学, 2012. LIU Kai-lin.Bioavailability of Ionizable Pesticides Nicosulfuron and Carbendazim in Soil[D]. Hangzhou:Zhejiang University, 2012. (  0) 0) |
| [96] |
KE R, XU Y, HUANG S, et al. Comparison of the Uptake of Polycyclic Aromatic Hydrocarbons and Organochlorine Pesticides by Semipermeable Membrane Devices and Caged Fish (Carassius carassius) in Taihu Lake, China[J]. Environmental Toxicology and Chemistry, 2007, 26(6): 1258-1264. DOI:10.1897/06-454R1.1 (  0) 0) |




