2. 环境保护部南京环境科学研究所, 江苏 南京 210042
2. Nanjing Institute of Environmental Sciences, Ministy of Environmental Protection, Nanjing 210042, China
在水生环境中, 水位抬升对植物的生长和分布影响很大[1-4]。尤其是异常强降雨导致的伏汛影响了水下光照强度[5-6], 增加了生境特异性[7-8], 从而显著影响植株形态和光合作用。以往的研究主要集中在水深梯度对水生植物生长的影响上[9-11]。沉水植物的植株形态和光合作用对水位抬升的响应研究较少[12-13]。沉水植物对水位抬升的响应机制尚不清楚, 不同物种对于水位抬升的适应机制不同, 具体表现为生长形式不同和光合作用的差异, 因此,研究水位抬升对沉水植物的生长及光合特性的影响是有意义的。
滆湖属浅水型湖泊, 水位抬升幅度极大。据常州水文资料统计, 滆湖水位一般5月起涨, 7月最高, 多年平均水位3.30 m, 历年最高水位5.45 m, 出现时间为1991年7月7日; 最低水位为2.44 m, 出现时间为1979年1月30日。选取滆湖水位抬升年份作为研究点, 现场模拟枯水年、平水年、丰水年的水位抬升情况, 设置低水位抬升(3 m)、中水位抬升(3.4 m)、高水位抬升(3.8 m)3种条件,研究水位抬升是否是滆湖沉水植物大面积消亡的主要原因, 以期为滆湖沉水植被的恢复提供科学依据。
1 材料与方法 1.1 实验材料实验用冠层型植物狐尾藻(Myriophyllum spicatum)叶轮生, 羽状全裂, 下部可形成没有叶片的光合茎, 属春季种。冠层型植物马来眼子菜(Potamogeton malaianus)叶互生, 生长于上部茎, 叶片膜质, 长椭圆形或椭圆状披针形, 喜高温, 属夏季种。直立型植物黑藻(Hydrilla verticillata)茎直立细长, 叶片轮生, 条状披针型, 属夏季种。莲座型植物密刺苦草(Vallisneria denseserrulata)叶片呈带状, 生长于底部的茎上, 属夏季种。
实验开始前, 选取采自滆湖湿地公园且形状相同的狐尾藻〔株高(30±4) cm〕、马来眼子菜〔株高(40±5) cm〕、黑藻〔株高(30±4) cm〕、密刺苦草〔株高(20±3) cm〕栽种于铺有约12 cm厚沉积物的种植盆(38 cm×26.5 cm×13 cm)中, 每盆种植20株。沉积物采用滆湖大洪港底泥, w(总氮)为(2.37±0.12) g·kg-1, w(总磷)为(1.21±0.09) g·kg-1。
1.2 实验方法实验地点位于江苏省常州市武进区滆湖大洪港, 该区域枯水期平均水位为2.8 m, 丰水期平均水位为3.8 m, 水质优于Ⅳ类。原位实验水池位于滆湖大洪港东部的滆湖湿地公园(31°38′39.23″ N, 119°53′7.94″ E)。共设计4个水池, 规格为4 m×4 m×2.5 m, 每个水池放置每种植物各10盆。实验周期为2015年6月20日至8月28日, 历时70 d。
实验用水取自滆湖大洪港, 用水泵直接将滆湖水泵入实验水池, 对照组设置相应水位为2.6 m(T0), 其他3个水池作为抬升组保持1 m水深30 d, 然后2 d之内均匀抬升水位, 实验第32天各抬升组相应水位为3.0 m(T1)、3.4 m(T2)、3.8 m(T3), 保持抬升后水位一直到第70天实验结束。在各个实验水池中, 所有处理水质等级均优于Ⅳ类, 各组的水质指标无显著变化(P>0.05, 表 1)。
|
|
表 1 实验初始水质情况 Table 1 Initial water qualities of the experiment |
实验结束时将每盆植物挖出清洗, 每种植物随机选取9株测量株高(h), 然后将地上部分和地下部分分开, 晾干后于85 ℃下烘干至恒量, 称质量得到地上生物量和地下生物量, 总生物量、根冠比、相对伸长率和相对生长率的计算公式如下:
| ${{W}_{总}}={{W}_{地上}}+{{W}_{地下}},$ | (1) |
| ${{R}_{{\rm{SR}}}}={{W}_{地上}}/{{W}_{地下}},$ | (2) |
| ${R_{{\rm{EG}}}} = \ln \left( {{h_2}/{h_1}} \right)/\Delta t,$ | (3) |
| ${R_{{\rm{GR}}}} = \ln \left( {{W_2}/{W_1}} \right)/\Delta t。$ | (4) |
式(1)~(4) 中, W总为总生物量, g; W地上和W地下分别为地上生物量和地下生物量, g; RSR为根冠比; W1和W2为实验开始和结束时某植物的总生物量, g; REG为相对伸长率, cm·d-1; h1和h2为实验开始和结束时某植物株高, cm; Δt为实验时间, d; RGR为相对生长率, g·d-1。
1.3.2 光照强度和透明度光照强度采用上海嘉定学联仪表厂生产的ZDS-10型照度计测定, 分别在晴、多云、阴雨3种不同天气条件下, 测量正午时实验池表层和不同水深梯度下的光照强度, 每种天气条件下测量3次, 取平均值。实验区水体透明度利用塞式透明度盘测量。
1.3.3 光合荧光参数快速光响应曲线(rapid light curves, RLCs)[14]测定:测试时间为上午10:00—11:00, 利用水下叶绿素荧光仪Diving-PAM(德国WALZ公司)和数据采集软件Wincontrol(Walz GmbH, Effeltrich Germany)进行测定。在野外观测现场, 每个处理选取植株中形态较为一致的9片叶片(距离顶端20 cm处)。光化光的强度梯度为0、39、102、192、325、485、664、979和1 324 μmol·m-2·s-1, 每个强度的光化光照射10 s, 2次光化光间隔20 s。在任一光合有效辐射值(photosynthetically active radiation, PAR, RPA)照射后, 记录荧光值Ft, 随后打开饱和脉冲得到最大荧光为Fm′, 由此可以得出光系统Ⅱ(PSⅡ)的有效量子产率(effective quantum yield, Y):
| $Y = ({F_{\rm{m}}}^\prime - {F_t})/{F_{\rm{m}}}^\prime 。$ | (5) |
根据Y和RPA可以计算出相对电子传递速率(rETR), 从而绘出平均值的快速光响应曲线。
| ${r_{{\rm{ETR}}}} = Y \times {R_{{\rm{PA}}}} \times 0.5 \times 0.84。$ | (6) |
快速光响应曲线拟合用SPSS 20.0软件进行, 采用最小二乘法, 根据RALPH等[15]和PLATT等[16]的公式:
| ${r_{{\rm{ETR}}}} = {r_{{\rm{ETR}},{\rm{m}}}}(1 - {{\rm{e}}^{ - \alpha \times {R_{{\rm{PA}}}}/{r_{{\rm{ETR}},{\rm{m}}}}}}) \times {{\rm{e}}^{ - \beta \times {R_{{\rm{PA}}}}/{r_{{\rm{ETR}},{\rm{m}}}}}}。$ | (7) |
式(5)~(7) 中, Ft为测量光测得的荧光值, mV; Fm′为打开饱和脉冲后测得的荧光值, mV; Y为PSⅡ的有效量子产率; RPA为有效辐射强度, μmol·m-2·s-1; rETR为相对光合电子传递速率, μmol·m-2·s-1; rETR,m为无光抑制时的最大潜在相对电子传递速率, μmol·m-2·s-1; α为rETR-PAR曲线的初始斜率; β为光抑制参数。
1.4 数据处理实验所得数据采用SPSS 20.0软件进行方差分析。
2 结果与分析 2.1 水位抬升与光强变化的响应关系对4个实验水池光照强度进行测定, 结果表明, 在不同水深梯度下光照强度差异极显著(P<0.001, 图 1)。随着水位的增加, 光照强度明显减小。4条曲线基本呈指数分布, 斜率差异不显著, 说明不同水位抬升方式的实验组光衰减差异不显著。水池表面,水下0.5、1.0、1.5和2.0 m处平均光照强度分别为30 624、8 316、4 976、2 733和1 105 lx。表面光强的27%、16%、9%和3%能到达水下0.5、1.0、1.5和2.0 m深度。
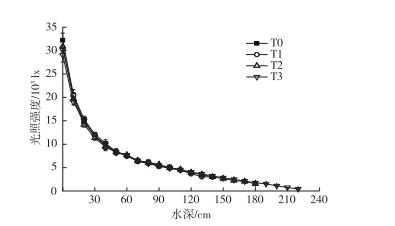
|
图 1 不同水位抬升幅度下光照强度随水深的变化 Figure 1 Variation of light intensity with rising water levels T0—相应水位为2. 6 m; T1—相应水位为3. 0 m; T2—相应水位为3. 4 m; T3—相应水位为3. 8 m. |
水位抬升显著影响4种植物的生物量、相对生长率、株高和相对伸长率(P<0.05), 但是不同幅度水位抬升对4种植物的影响不同。随着水位抬升幅度的增加, 4种植物的株高显著增加(图 2), 尤其是低水位抬升和中水位抬升, 表明4种沉水植物都通过增加株高来响应水位抬升。狐尾藻和马来眼子菜的相对伸长率显著高于黑藻和密刺苦草(P<0.05), 水位抬升条件下, 狐尾藻和马来眼子菜生长快速, 相对伸长率分别为0.04~0.05和0.05~0.07 cm·d-1。黑藻和密刺苦草生长缓慢, 相对伸长率分别为0.03~0.04和0.01~0.03 cm·d-1, 说明冠层型植物的形态可塑性优于直立型和莲座型植物。
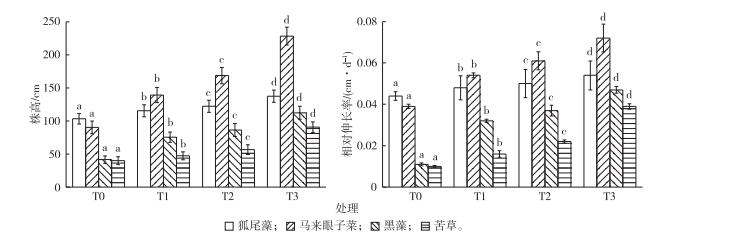
|
图 2 水位抬升对4种沉水植物株高和相对伸长率的影响 Figure 2 Response of plant height and relative elongation rate of four submersed macrophytes to rising water levels T0—相应水位为2.6 m; T1—相应水位为3.0 m; T2—相应水位为3.4 m; T3—相应水位为3.8 m。直方柱上方英文小写字母不同表示不同处理组间某指标差异显著(P<0.05)。 |
冠层型植物狐尾藻和马来眼子菜的生物量随着水位抬升幅度的增加而显著增加(P<0.05, 图 3), 狐尾藻生物量由T0组的0.59增加到T3组的0.92 g, 马来眼子菜生物量由T0组的0.48增加到T3组的0.96 g。从生物量和相对生长率可以看出, 水位抬升促进了以狐尾藻、马来眼子菜为代表的冠层型植物的生长。T0、T1和T2组黑藻生物量分别为0.21、0.20和0.20 g, 各组间差异不显著(P>0.05)。T3组黑藻生物量为0.14 g, 高水位抬升条件下黑藻生物量显著减小(P<0.05)。T0组密刺苦草生物量为0.48 g, 随水位抬升幅度的增加密刺苦草生物量显著减小(P<0.05), T1、T2和T3组黑藻生物量分别减少28%、29%和38%, 水位抬升明显抑制了密刺苦草的生长。
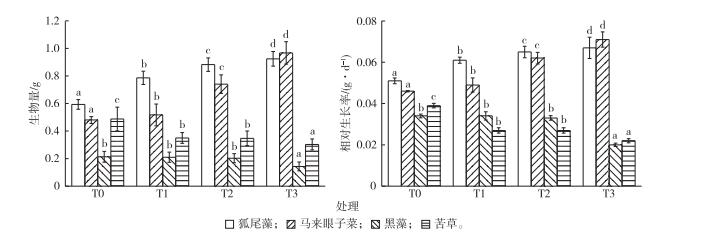
|
图 3 水位抬升对4种沉水植物生物量和相对生长率的影响 Figure 3 Response of biomass and relative growth rate of four submersed macrophytes to rising water levels T0—相应水位为2.6 m; T1—相应水位为3.0 m; T2—相应水位为3.4 m; T3—相应水位为3.8 m。直方柱上方英文小写字母不同表示不同处理组间某指标差异显著(P<0.05)。 |
随水位抬升幅度的增加, 冠层型植物和直立型植物地上生物量显著增加(P<0.05), 地下生物量和根冠比显著减少(P<0.05), 植物的定植能力减弱。但是与其他植物不同, 莲座型植物密刺苦草的地上生物量由T0组的0.37减少到T3组的0.21 g, 地下生物量由T0组的0.09增加到T3组的0.11 g, 根冠比增大, 根冠比最高为0.48, 定植能力增强(图 4)。这表明水位抬升减弱了以狐尾藻、马来眼子菜为代表的冠层型植物和以黑藻为代表的直立型植物的定植能力, 增强了以密刺苦草为代表的莲座型植物的定植能力。
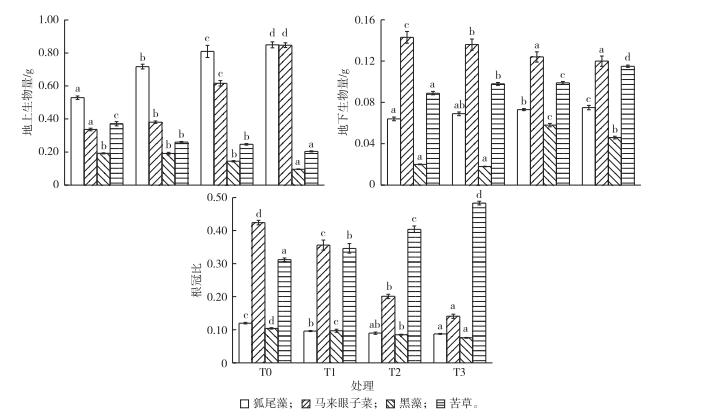
|
图 4 水位抬升对4种沉水植物生物量分配和根冠比的影响 Figure 4 Response of biomass allocation of four submersed macrophytes to rising water levels T0—相应水位为2.6 m; T1—相应水位为3.0 m; T2—相应水位为3.4 m; T3—相应水位为3.8 m。直方柱上方英文小写字母不同表示不同处理组间某指标差异显著(P<0.05)。 |
快速光响应曲线(RLCs)描述了PSⅡ的相对光合电子传递速率(rETR), 反映实际光强下的光化学效率。拟合并分析RLCs(图 5), 获得反映光合能力的参数rETR,m和α(表 2)。
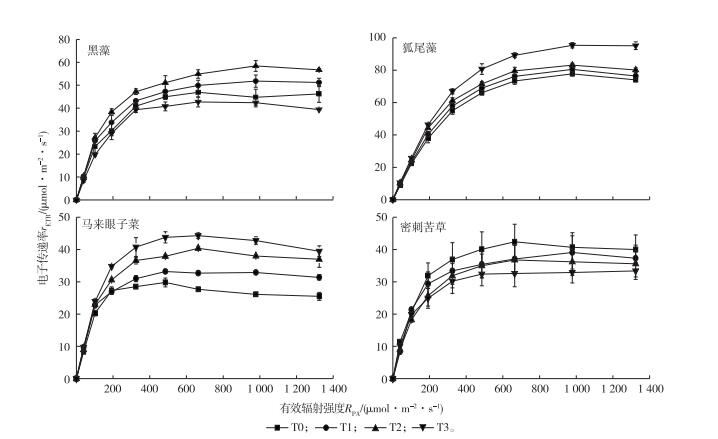
|
图 5 水位抬升对4种沉水植物快速光响应曲线和根冠比(RLCs)的影响 Figure 5 Response of rapid light curves of four submersed macrophytes to rising water levels T0—相应水位为2.6 m; T1—相应水位为3.0 m; T2—相应水位为3.4 m; T3—相应水位为3.8 m。 |
|
|
表 2 快速光响应曲线(RLCs)参数拟合结果 Table 2 Parameter values of rapid light curves |
冠层型植物狐尾藻和马来眼子菜rETR, m和α随水位抬升幅度的增加显著增加(P<0.05), T3组狐尾藻rETR, m比T0组增加22%, 马来眼子菜增加48%, 表明水位抬升增强了以狐尾藻、马来眼子菜为代表的冠层型植物的叶片光合效率, 冠层型植物光合作用能力提高。直立型植物黑藻rETR, m和α均在相对中水位抬升条件下最高, 中水位抬升下黑藻的rETR, m和α分别为58.43 μmol·m-2·s-1和0.27。密刺苦草的α随水位抬升幅度的增加而减小, 由T0组的0.25减少到T3组的0.22, rETR, m变化不显著(P>0.05)。
3 讨论 3.1 水位抬升对沉水植物生长的影响随着水位抬升幅度的增加, 水生植物通过增加株高并减少地下生物量来响应水位抬升[17], 这可能是植物应对弱光条件的生长策略。BEST等[18]指出, 随着水下光强的减弱, 绿光越来越多, 红光越来越少, 刺激了沉水植物茎的伸长。笔者研究结果与之相一致。
高水位抬升可能导致资源限制[19]。王丽等[20]认为静态条件下环境相对稳定, 植物不必寻求资源来蓄积能量, 当所处环境较为恶劣时, 需要寻求资源以维持生长, 这可能会导致主要合成物质减少, 植物生物量下降。在水位抬升条件下, 以黑藻为代表的直立型和以密刺苦草为代表的莲座型植物生物量减小, 茎的伸长以植物的生长为代价, 这主要是因为水下光强变弱, 光合作用合成的碳水化合物更多用于细胞伸长, 用于植物组织生长的碳水化合物将减少[21], 地上和地下生物量都减少[22]。芦苇(Phragmites australlis)[19]和水车前(Ottelia alismoides)[13]都有类似的研究报道。但冠层型植物的株高和生物量均增加, 植物生长到水面后能沿水面生长, 生物量主要集中在水体上层或表面。这个结果表明适度的水位抬升有利于植物生长, 包括增加植物的活力和生物量等[23]。
植物适应资源不平衡是通过分配新的生物量到最受限制的器官[24]。4种沉水植物地上部分生物量大于地下部分, 冠层型和直立型植物通过分配更多的生物量到茎以增加株高, 表现为地上生物量更大。根据BARRAT-SEGRETAIN[25]的研究, 生物量分配到地上部分可能是在适应变化的生境, 生物量分配到地下部分与植物定植能力显著相关。更多的生物量被分配到地上部分[26], 以获取足够的光合产物并完成有性繁殖[27]。
3.2 水位抬升对沉水植物光合作用的影响光合作用是沉水植物最重要的代谢活动。水生植物的光合作用能力受植物本身和外界环境因子的双重影响, 其核心是快速光响应曲线[28]。快速光响应曲线可以基本反映样品的自然光合状态, 实验表明水位抬升对4种植物的快速光响应曲线的影响显著。
在水位抬升条件下, 冠层型植物rETR,m和α均增加, 最大光合速率和叶片捕光能力上升, 说明冠层型植物能在各种复杂的环境下通过光合荧光参数的改变来实现自身的生存需求, 反映了冠层型植物在非最佳生长条件下对环境的适应性。冠层型植物光合荧光参数的改变体现出其对弱光逆境的适应策略, 光合产物更多用于上部叶片和茎的伸长, 有利于植株上部冠层的形成, 从而有效增加植株上部叶片接受到的光照强度, 减轻弱光逆境的影响。VAN等[29]研究发现, 冠层型植物能够把生物量的95%分配给光合组织, 在近水面形成茂密的冠层。冠层是进行光合作用的主要部位, 其形成有利于植物进行光合作用。叶片吸收的光能更多地参与光化学反应, 合成更多的光合产物。
低水位和中水位抬升促进了黑藻的光合作用, 高水位抬升抑制了黑藻的光合作用, 说明水位抬升是影响黑藻光合作用的重要因素之一, 适度的水位抬升有利于黑藻光合作用。适度的水位抬升使得黑藻叶片吸收的能量更多参与光化学反应, 最大光合速率增大, 合成更多的光合产物[30]。在适度低光条件下黑藻植株能更有效地利用吸收的光能, 合成生长所需的物质。
随着水位抬升幅度的增加, 密刺苦草的光合作用能力降低,主要表现在对光合系统PSⅡ的影响方面。密刺苦草叶片的rETR,m和α随水位抬升幅度增加呈下降趋势, 表明密刺苦草在水位抬升条件下PSⅡ光能转换效率显著下降, 进入PSⅡ光化学过程的激发能减少, PSⅡ关闭程度加大, 光合产物合成减少。
光合速率更高的冠层型植物在人工配置沉水植物群落时会作为优先考虑的物种, 因为光合作用是植物合成干物质的基础, 只有光合能力更高, 才能使植物贮藏更多的营养物质。笔者研究所用的底泥和水全部取自滆湖大洪港, 在实验期间水位抬升虽然对狐尾藻、马来眼子菜、黑藻和密刺苦草生长情况有些影响, 但均没有出现消亡迹象, 可见,在滆湖大洪港的营养水平下, 水位抬升幅度在1.0~1.2 m范围内不会对沉水植物生长造成毁灭性影响, 因此单纯的水位变动不是滆湖沉水植物消亡的原因, 可能还有浊度升高、水下光照下降等其他因素的协同作用。
4 结论在现场实验条件下, 模拟了3种水位抬升方式, 即相对低水位、中水位和高水位, 均先保持2.6 m水位30 d, 然后在2 d内迅速抬高, 之后一直保持70 d。结果表明, 水位抬高促进了狐尾藻和马来眼子菜的生长, 其光合作用效率也显著提高。在相对中水位抬升条件下黑藻长势最好, 生物量达到0.21 g, 光合作用效率高于其他实验组。水位抬升抑制了密刺苦草生长, 表现为生物量下降,光合效率降低, 叶片捕光能力下降。因此, 以狐尾藻、马来眼子菜为代表的冠层型植物从形态学响应和光合作用能力上更适合滆湖历史水位抬升, 可以作为滆湖沉水植被恢复的推荐物种。一定程度的水位抬升对植物的生长有较大影响,但是并未导致消亡, 植物消亡可能还与浊度升高和水下光照等因素有关。
| [1] |
SOUSA W T Z, THOMAZ S M, MURPHY K J. Response of Native Egeria najas Planch.and Invasive Hydrill averticillata (L.f.) Royle to Altered Hydroecological Regime in a Subtropical River[J]. Aquatic Botany, 2010, 92(1): 40-48. DOI:10.1016/j.aquabot.2009.10.002 (  0) 0) |
| [2] |
CASANOVA M T, BROCK M A. How Do Depth, Duration and Frequency of Flooding Influence the Establishment of Wetland Plant Communities?[J]. Plant Ecology, 2000, 147(2): 237-250. DOI:10.1023/A:1009875226637 (  0) 0) |
| [3] |
THOMAZ S M, PAGIORO T A, BINI L M, et al. Effect of Reservoir Drawdown on Biomass of Three Species of Aquatic Macrophytes in a Large Sub-Tropical Reservoir (Itaipu, Brazil)[J]. Hydrobiologia, 2006, 570(1): 53-59. DOI:10.1007/s10750-006-0161-9 (  0) 0) |
| [4] |
沈琪, 刘珂, 李世玉, 等. 杭州西溪湿地植物组成及其与水位光照的关系[J]. 植物生态学报, 2008, 32(1): 114-122. SHEN Qi, LIU Ke, LI Shi-yu, et al. Relationships of Plant Composition, Water Level and Solar Radiation in Xixi Wetland, Hangzhou, China[J]. Journal of Plant Ecology, 2008, 32(1): 114-122. (  0) 0) |
| [5] |
BORNETTE G, PIEGAY H, CITTERIO A, et al. Aquatic Plant Diversity in Four River Floodplains:A Comparison at Two Hierarchical Levels[J]. Biodiversity & Conservation, 2001, 10(10): 1683-1701. (  0) 0) |
| [6] |
WARD J V, TOCKNER K. Biodiversity:Towards a Unifying Theme for River Ecology[J]. Freshwater Biology, 2001, 46(6): 807-820. DOI:10.1046/j.1365-2427.2001.00713.x (  0) 0) |
| [7] |
杨鑫, 孙淑雲, 柏祥, 等. 水深梯度对苦草(Vallisneria natans)光合荧光特性的影响[J]. 湖泊科学, 2014, 26(6): 879-886. YANG Xin, SUN Shu-yun, BAI Xiang, et al. Influences of Water Depth Gradient on Photosynthetic Fluorescence Characteristics of Vallisneria natans[J]. Journal of Lake Sciences, 2014, 26(6): 879-886. DOI:10.18307/2014.0610 (  0) 0) |
| [8] |
PARSONS M, MCLOUGHLIN C A, KOTSCHY K A, et al. The Effects of Extreme Floods on the Biophysical Heterogeneity of River Landscapes[J]. Frontiers in Ecology and the Environment, 2005, 3(9): 487-494. DOI:10.1890/1540-9295(2005)003[0487:TEOEFO]2.0.CO;2 (  0) 0) |
| [9] |
翟水晶, 胡维平, 邓建才, 等. 不同水深和底质对太湖马来眼子菜(Potamogeton malaianus)生长的影响[J]. 生态学报, 2008, 28(7): 3035-3041. ZHAI Shui-jing, HU Wei-ping, DENG Jian-cai, et al. Effects of Different Water Depths and Sediments on Potamogeton malaianus in Lake Taihu[J]. Acta Ecologica Sinica, 2008, 28(7): 3035-3041. (  0) 0) |
| [10] |
MACEK P, REJMÁNKOVÁ E, HOUDKOVÁ K. The Effect of Long-Term Submergence on Functional Properties of Eleocharis cellulose Torr[J]. Aquatic Botany, 2006, 84(3): 251-258. DOI:10.1016/j.aquabot.2005.11.003 (  0) 0) |
| [11] |
MAUCHAMP A, BLANCH S, GRILLAS P. Effects of Submergence on the Growth of Phragmites australis Seedlings[J]. Aquatic Botany, 2001, 69(2): 147-164. (  0) 0) |
| [12] |
吴晓东, 王国祥, 魏宏农, 等. 模拟水位上升对黑藻生长的影响[J]. 湖泊科学, 2001, 24(3): 384-390. WU Xiao-dong, WANG Guo-xiang, WEI Hong-nong, et al. Growth Responses of Hydrilla verticillata to Increasing Water Levels[J]. Journal of Lake Sciences, 2001, 24(3): 384-390. (  0) 0) |
| [13] |
YU L F, YU D. Responses of the Threatened Aquatic Plant Ottelia alismoides to Water Level Fluctuations[J]. Fundamental & Applied Limnology, 2009, 174(4): 295-300. (  0) 0) |
| [14] |
SCHREIBER U, GADEMANN R, RALPH P J, et al. Assessment of Photosynthetic Performance of Prochloron in Lissoclinum patella in Hospite by Chlorophyll Fluorescence Measurements[J]. Plant and Cell Physiology, 1997, 38(8): 945-951. DOI:10.1093/oxfordjournals.pcp.a029256 (  0) 0) |
| [15] |
RALPH P J, GADEMANN R. Rapid Light Curves:A Powerful Tool to Assess Photosynthetic Activity[J]. Aquatic Botany, 2005, 82(3): 222-237. DOI:10.1016/j.aquabot.2005.02.006 (  0) 0) |
| [16] |
PLATT T, GALLEGOS C L, HARRISON W G. Photo Inhibition of Photosynthesis in Natural Assemblages of Marine Phytoplankton[J]. Publications-Astronomical Society of Japan, 1980, 57(57): 341-345. (  0) 0) |
| [17] |
李亚芳, 陈心胜, 项文化, 等. 不同高程短尖苔草对水位变化的生长及繁殖响应[J]. 生态学报, 2015, 36(7): 1959-1966. LI Ya-fang, CHEN Xin-sheng, XIANG Wen-hua, et al. Effects of Water Levels on the Growth and Reproductive Characteristics of Carex brevicuspis Growing on Sites With Different Elevations[J]. Acta Ecologica Sinica, 2015, 36(7): 1959-1966. (  0) 0) |
| [18] |
BEST E P H, BUZZELLI C P, BARTELL S M, et al. Modeling Submersed Macrophyte Growth in Relation to Underwater Light Climate:Modeling Approaches and Application Potential[J]. Hydrobiologia, 2001, 444(1): 43-70. (  0) 0) |
| [19] |
DEEGAN B M, WHITE S D, GANF G G. The Influence of Water Level Fluctuations on the Growth of Four Emergent Macrophyte Species[J]. Aquatic Botany, 2007, 86(4): 309-315. DOI:10.1016/j.aquabot.2006.11.006 (  0) 0) |
| [20] |
王丽, 胡金明, 宋长春, 等. 波动和静止水文情势下小叶章(Calamagrostis angustifolia)的生理生态特征[J]. 生态学报, 2008, 28(4): 1794-1801. WANG Li, HU Jin-ming, SONG Chang-chun, et al. A Comparison of Some Eco-Physiological Characters of Calamagrostis angustifolia Under Variable and Static Water Regimes[J]. Acta Ecologica Sinica, 2008, 28(4): 1794-1801. (  0) 0) |
| [21] |
VOESENEK L, COLMER T D, PIERIK R, et al. How Plants Cope With Complete Submergence[J]. New Phytologist, 2006, 170(2): 213-226. DOI:10.1111/nph.2006.170.issue-2 (  0) 0) |
| [22] |
王立志, 王国祥, 葛绪广, 等. 底质营养盐负荷对轮叶黑藻生长和光合荧光特性的影响[J]. 生态学报, 2010, 30(2): 473-480. WANG Li-zhi, WANG Guo-xiang, GE Xu-guang, et al. Influence of Different Sediment Nutrients on Growth and Photosynthesis Fluorescence Characteristics of Hydrilla verticillata(L.f) Royle[J]. Acta Ecologica Sinica, 2010, 30(2): 473-480. (  0) 0) |
| [23] |
ZHANG X K, LIU X Q, DING Q Z. Morphological Responses to Water-Level Fluctuations of Two Submerged Macrophytes, Myriophyllum spicatum and Hydrilla verticillata[J]. Journal of Plant Ecology, 2013, 6(1): 64-70. DOI:10.1093/jpe/rts009 (  0) 0) |
| [24] |
CHAPIN F S, BLOOM A J, FIELD C B, et al. Plant Responses to Multiple Environmental Factors[J]. Bioscience, 1987, 37(1): 49-57. DOI:10.2307/1310177 (  0) 0) |
| [25] |
BARRAT-SEGRETAIN M H. Biomass Allocation in Three Macrophyte Species in Relation to the Disturbance Level of Their Habitat[J]. Freshwater Biology, 2001, 46(7): 935-945. DOI:10.1046/j.1365-2427.2001.00728.x (  0) 0) |
| [26] |
STRAND J A, WEISNER S E B. Morphological Plastic Responses to Water Depth and Wave Exposure in an Aquatic Plant (Myriophyllum spicatum)[J]. Journal of Ecology, 2001, 89(2): 166-175. DOI:10.1046/j.1365-2745.2001.00530.x (  0) 0) |
| [27] |
贾美玉, 李雪华, 吴忠铉, 等. 科尔沁沙地流动沙丘3种常见植物的空间分布格局与异速生长[J]. 应用生态学报, 2015, 26(10): 2953-2960. JIA Mei-yu, LI Xue-hua, WU Zhong-xuan, et al. Spatial Distribution Pattern and Allometric Growth of Three Common Species on Moving Sand Dunes in Horqin Sandy Land, China[J]. Chinese Journal of Applied Ecology, 2015, 26(10): 2953-2960. (  0) 0) |
| [28] |
宋玉芝, 蔡炜, 秦伯强. 太湖常见浮叶植物和沉水植物的光合荧光特性比较[J]. 应用生态学报, 2009, 20(3): 569-573. SONG Yu-zhi, CAI Wei, QIN Bo-qiang. Photosynthetic Fluorescence Characteristics of Floating-Leaved and Submersed Macrophytes Commonly Found in Taihu Lake[J]. Chinese Journal of Applied Ecology, 2009, 20(3): 569-573. (  0) 0) |
| [29] |
VAN T K, WHEELER G S, CENTER T D. Competition Between Hydrilla verticillata and Vallisneria Americana as Influenced by Soil Fertility[J]. Aquatic Botany, 1999, 62(4): 225-233. DOI:10.1016/S0304-3770(98)00100-4 (  0) 0) |
| [30] |
李强, 朱启红, 丁武泉, 等. 水体泥沙对菖蒲和石菖蒲生长发育的影响[J]. 生态学报, 2011, 31(5): 1341-1348. LI Qiang, ZHU Qi-hong, DING Wu-quan, et al. Influence of Silts on Growth and Development of Acorus calamus and Acorus tatarinowii in Turbid Water[J]. Acta Ecologica Sinica, 2011, 31(5): 1341-1348. (  0) 0) |




