2. 环境保护部南京环境科学研究所, 江苏 南京 210042
2. Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China
有机氯农药(organochlorine pesticides, OCPs)曾在世界范围内大量使用, 虽自20世纪80年代起被禁止生产和使用, 但遗留的土壤污染问题一直是关注的重点。自金属铁还原处理氯代脂肪烃的稀溶液被报道以来, 由于具有绿色经济等特点, 零价铁(zero valentiron, ZVI)还原过程也被用来降解土壤中的OCPs[1]。现有研究表明, 普通ZVI对场地土壤中OCPs, 特别是DDTs等降解效果并不理想[2-3]。基于表面活性剂增溶强化的乳化ZVI体系被提出以实现污染土壤中OCPs的快速转化降解[4]。但总的来说, 化学还原处理难以实现土壤中氯代污染物的完全降解, 更不能反映修复后土壤的生理生态变化。目前对于土壤修复效果的判定多是对土壤中目标污染物的浓度与修复目标或限值进行比较, 在很多情况下不能全面、科学地反映土壤的整体环境质量, 有时甚至会导致一些错误结论[5]。如有研究发现土壤中的有机物经过修复反而生成了毒性更强的污染物[6-7]。因此, 在土壤中OCPs更为彻底的降解的同时, 改善ZVI处理后的土壤生境也是需要关注的问题。
磷脂脂肪酸(phospholipid fatty acids, PLFAs)作为微生物的生物标记[8], 具有较高的准确性、稳定性和敏感性[9], 由国外学者提出并广泛地应用于土壤微生物群落研究[10-11]中。国内学者近年来也做了很多相关研究, 张秋芳等[12]利用PLFAs技术发现烟土土壤中起主导作用的功能菌是真菌、假单胞菌、甲烷氧化菌和部分好氧菌、厌氧菌及硫酸盐还原菌。宁欣强等[13]利用PLFAs技术分析了A+OSA污泥减量工艺微生物的群落结构变化。吴振斌等[14]利用磷脂脂肪酸技术研究了人工湿地微生物群落结构。陈晓娟等[15]利用PLFAs和MicroRespTM方法分析了不同耕地利用方式下土壤微生物活性及群落结构特性。
PLFAs的变化和样品中微生物种类的变化呈正相关关系, 因此通过提取分析PLFAs可以比较准确反映样品中微生物群落的组成结构变化[16]。常见的用于分析PLFAs谱图的方法主要有将测得的PLFAs直接用主成分分析(principal components analysis, PCA)、部分最小二乘法识别(partial least squares, PLS)和群落多余度分析(redundancy analysis, RDA)等[17]。利用磷脂脂肪酸(PLFAs)技术, 以杭州某农药厂污染场地土壤为例, 分析不同ZVI处理方式下土壤培养反应过程中的微生物群落结构, 考察土壤培养过程中微生物类群PLFAs动态变化, 尝试从生态功能恢复方面评价不同的零价铁体系修复有机氯农药污染土壤的效果。
1 材料与方法 1.1 供试土壤从杭州某有机氯农药生产企业遗留污染场地采集土壤样品。试验土壤为砂质壤土, 弱碱性, 主要污染物为六六六(HCH)和滴滴涕(DDT)。土壤主要理化性质:粒径分布>0.2~2 mm占3.48%, >0.02~0.2 mm占67.9%, 0.002~0.02 mm占17.0%, < 0.002 mm占11.6%;w)(有机质)为52.0 g·kg-1; pH值为5.2;主要目标污染物w(α-HCH)为3.59 mg·kg-1, w)(γ)-HCH)为10.1 g·kg-1, w)(p, p′-DDD)为5.38 g·kg-1, w)(p, p′-DDT)为19.0 g·kg-1。
1.2 试验设计共开展4组土壤培养试验, 即空白试验、还原铁粉、微米Fe/Cu、微米Fe/Cu+5 mmol·L-1TX-100。每组样品设置2个平行, 具体条件见表 1。各组均采用0.3 mmol·L-1醋酸控制初始pH值为4.5左右。
土壤培养试验步骤为:称取10.0 g还原铁粉制备所需零价铁和微米Fe/Cu, 水洗至中性后迅速称取200 g污染土(干重)加入500 mL具塞塑料罐中, 加入90 mL表面活性剂溶液, 混合搅拌均匀盖紧, 置于智能人工气候箱中放置培养。于0、5、15、25、35、45、55、65、75、85、95及105 d时取土样4.0 g, 进行PLFAs测定。
|
|
表 1 土壤培养试验设计 Table 1 Design of the soil incubation experiment |
采用修正的Bligh-dyer法[18]振荡提取总脂, 经硅胶柱层析分离得到磷脂脂肪酸。甲酯化后, 以酯化的C19:0为内标, 用气相色谱仪(GC6850, Agilent Technologies Co., USA)进行测定, 检测温度为21 ℃, 湿度为58%。H2和N2进气气压示数在0.35左右, 空气示数在0.42左右。应用美国MIDI公司开发的Sherlock MIS 4.5系统分析鉴定微生物类群。不同类群微生物具有独特的PLFAs特征谱图, 可以对微生物群落进行识别和定量分析。
TX-100(分析纯)产自美国捷倍思有限公司; 还原铁粉(分析纯, 粒径 < 0.150 mm)购于南京化学试剂厂; 丙酮(色谱纯)和正己烷(色谱纯)购于德国Merk公司; CuCl2·2H2O、NiCl2·6H2O(分析纯, w)为99.0%)购于国药集团化学试剂有限公司; 超纯水由美国Milli Q系统提供。
1.4 数据分析PLFAs数据采用SPSS 19.0进行主成分分析(PCA)。
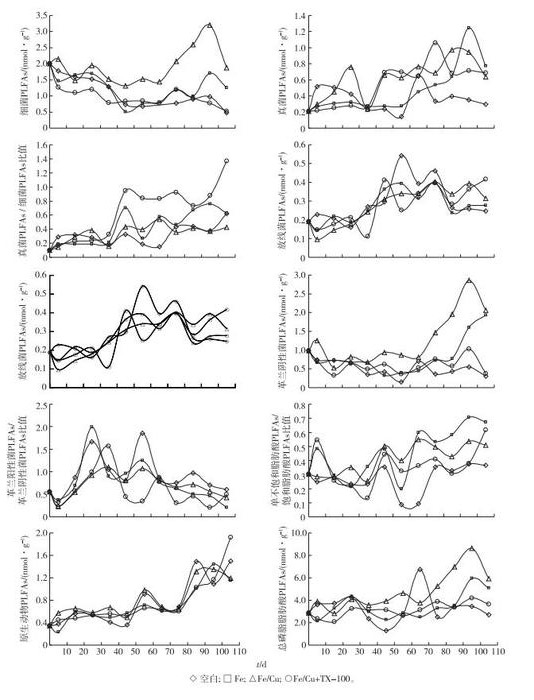
2 结果与讨论 2.1 培养过程中土壤微生物类群PLFAs变化土壤中测定出现的PLFAs标记物及对应指示的特定微生物见表 2。由图 1可见,对于细菌与真菌, Fe/Cu+TX-100组与空白组细菌呈减少趋势, 可能与TX-100具有一定的毒性有关。许多化学表面活性剂对微生物都具有一定的毒性, 这主要是由于化学表面活性剂往往能够溶解细胞酶、细胞受体和蛋白质, 并导致细胞膜生理功能紊乱或膜结构损伤, 从而改变细胞膜的通透性, 并导致胞内物质的流失[21]。TX-100的加入抑制了某些细菌的生长, 但真菌未受影响, 除空白组外各组真菌均呈增加趋势。土壤真菌对于土壤肥力有着举足轻重的作用。土壤中的真菌一方面可以分解土壤中的有机质,从而形成腐殖质并释放养分, 另一方面又同化土壤碳素和固定无机营养, 形成真菌生物量[21]。此外, 土壤真菌PLFAs/细菌PLFAs比值也通常用于表征土壤中2个种群的相对丰富程度及土壤生态系统的稳定性[22], 比值越高, 土壤生态系统越持续稳定。由图 1所示, 各组真菌/细菌PLFAs比值均呈上升趋势, Fe/Cu+TX-100组尤为明显, 这也与笔者前期研究中土壤中的污染物降解规律一致[23]。
|
图 1 不同处理过程中土壤微生物类群磷脂脂肪酸(PLFAs)的变化 Figure 1 Variation of PLFAs of the microbial groups in the soil relative to treatment |
表面活性剂的加入对于革兰阳性菌和革兰阴性菌均有一定的抑制作用, Fe组革兰阴性菌略有增加,而Fe/Cu组革兰阳性菌与革兰阴性菌明显增加。
革兰阳性菌/革兰阴性菌比值可以指示土壤营养状况[24], 比值越高表示其营养胁迫越强, 且土壤微生物生态系统受到的干扰也加强。Fe组革兰阳性菌/革兰阴性菌比值较空白组有所降低, 而其他2组则升高。
单不饱和脂肪酸/饱和脂肪酸比值可以表示土壤中好氧细菌与厌氧细菌的相对优势, 从而反映土壤的通气条件, 单不饱和脂肪酸/饱和脂肪酸比值越高表示土壤通气条件越好[25]。从图 1可知,各组比值均呈上升趋势, Fe和Fe/Cu+TX-100处理对土壤通气有明显促进作用。
各组原生动物PLFAs数值均呈明显上升趋势。Fe/Cu+TX-100组原生动物PLFAs由最初的0.34增加到105 d时的1.90 nmol·g-1, Fe、Fe/Cu和空白组在105 d时也分别达1.15、1.19和1.50 nmol·g-1。原生动物虽然是真核生物, 但它对环境变化的反应与后生动物很相似, 会对土壤环境的细微变化做出相应的反应, 目前有将原生动物作为不同污染物的指示生物的研究。
土壤细菌一般占土壤微生物总数的70%~90%, 在供试土壤中细菌总PLFAs值为2.00 nmol·g-1, 其他微生物都在0.2~0.5 nmol·g-1左右。可能是因为TX-100的毒性, 加入TX-100处理组细菌量较少, 因此总PLFAs在Fe/Cu+TX-100处理组中虽也有增加, 但少于Fe和Fe/Cu处理组。105 d时Fe、Fe/Cu和Fe/Cu+TX-100组总PLFAs分别为5.10、5.90和3.66 nmol·g-1, 均显著高于空白组(2.72 nmol·g-1, P) < 0.05), 表明处理过程有助于污染土壤微生物的增加, 即有助于污染土壤的生态功能恢复。
2.2 培养过程中土壤微生物菌群结构分析土壤微生物群落结构是土壤生态系统的重要功能组分, 它们通过调节自身体内一系列的生物化学反应或过程来主动或被动地响应环境变化。PLFAs是微生物细胞膜的重要组成部分, 其种类和组成比例可用以鉴别污染土壤微生物群落结构多样性变化[26]。
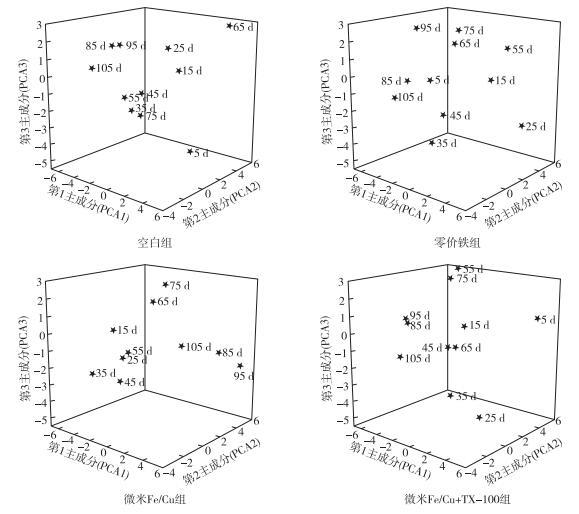
对空白组PLFAs进行主成分分析, 共提取3个主成分。其中, 第1主成分(PCA1) 贡献率是38.16%, 第2主成分(PCA2) 贡献率是17.61%, 第3主成分(PCA3) 贡献率是13.23%。如图 2可知, 空白组处理中期(35、45、55、75 d)与处理后期(85、95、105 d)微生物群落结构在第1与第3主成分上出现明显的分布差异, 处理后期的土壤微生物群落结构相似, 分布于第3主成分正方向上; 而处理中期分布于第3主成分负方向上; 处理前期(5、15、25 d)微生物群落结构与其他2个处理期在在第1与第3主成分上出现明显的分布差异。单个PLFAs初始载荷因子主成分分析结果表明, 以第1主成分起主要作用的PLFAs是12:0、13:0 DMA、15:4 w3c、15:0 iso、16:0 iso、a16:0、16:1 w7c、18:1 w9c、22:5 w3c, 对第2主成分起主要作用的PLFAs是16:1 w7c、17:1 w7c、cy17:0 w7c、18:1 w9c、18:1 w7c、18:0、cy19:0 w9c, 对第3主成分起主要作用的PLFAs是12:0、13:1 w5c、cy19:0 w9c。
|
图 2 不同处理组土壤中微生物群落PLFAs的主成分分析 Figure 2 Principal components analysis of PLFAs of the soil microbial community relative to treatment |
对零价铁处理组PLFAs进行主成分分析, 提取3个主成分。其中, 第1主成分贡献率是44.67%, 第2主成分贡献率是15.18%, 第3主成分贡献率是12.51%。如图 2可知, 处理中期(55、65、75 d)与处理后期(85、95、105 d)微生物群落结构在第2主成分出现分布差异, 处理中期(35、45 d)与处理后期微生物群落结构在第3主成分出现分布差异, 在第3主成分的负方向上; 处理前期(15、25 d)微生物群落结构与其他2个处理期在第1主成分上出现明显的分布差异。单个PLFAs初始载荷因子主成分分析结果表明, 以第1主成分起主要作用的PLFAs是13:1 w5c、14:0、14:0 iso、15:4 w3c、15:0 iso、a16:0、16:1 w7c、20:0 10Me、22:5 w3c, 对第2主成分起主要作用的PLFAs是a11:012:0、13:1 w5c、13:0 DMA、17:1 iso w9c、18:0, 对第3主成分起主要作用的PLFAs是15:3 w3c、18:3 w6c、18:0 iso、19:1 w8c。
对微米Fe/Cu处理组PLFAs进行主成分分析, 提取3个主成分。其中, 第1主成分贡献率是49.59%, 第2主成分贡献率是14.42%, 第3主成分贡献率是11.97%。如图 2可知, 处理后期(85、95、105 d)微生物群落结构相似,都在第1主成分的正方向上, 其他时期都在第1主成分的负方向上, 分布差异明显; 处理中期(65、75 d)与前期(15、25、35、45、55 d)在第2主成分与第3主成分的差异明显。单个PLFAs初始载荷因子主成分分析结果表明, 以第1主成分起主要作用的PLFAs是13:0 DMA、a17:0、a17:1 w7c、17:1 w7c、17:0、18:1 w7c、18:0 DMA、19:3 w6c、19:1 w8c、cy19:0 w9c、23:3 w3c, 对第2主成分起主要作用的PLFAs是14:0、14:0 iso、15:3 w3c、16:0 iso18:2 w6c、18:1 w9c, 对第3主成分起主要作用的PLFAs是16:0、cy17:0 w7c、19:0、21:3 w3c。
对微米Fe/Cu+TX-100处理组PLFAs进行主成分分析, 提取3个主成分。其中, 第1主成分贡献率是35.74%, 第2主成分贡献率是20.50%, 第3主成分贡献率是15.35%。如图 2可知, 空白组处理中期(45、55、65、75 d)与处理后期(85、95、105 d)微生物群落结构的分布差异出现在第1主成分上与第3主成分上; 处理前期(5、15、25 d)微生物群落结构与处理后期在第1主成分有分布差异。微米Fe/Cu+TX-100组单个PLFAs初始载荷因子主成分分析结果表明, 以第1主成分起主要作用的PLFAs是12:0、14:0 iso、15:4 w3c、a16:0、16:1 w7c、20:0 10Me, 对第2主成分起主要作用的PLFAs是16:0 iso、16:0、17:1 w7c、18:1 w7c、19:1 w8c、cy19:0 w9c、19:0, 对第3主成分起主要作用的PLFAs是16:3 w6c、cy 17:0 w7c、18:3 w6c、24:4 w6c。
在处理前期出现的PLFAs主要是16:1 w7c、17:1 w7c、cy17:0 w7c、18:1 w9c、18:1 w7c、18:0、cy 19:0 w9c, 12:0、14:0 iso、15:4 w3c、a16:0、16:1 w7c、20:0 10Me, 处理中期出现的PLFAs主要是a11:0、12:0、13:1 w5c、13:0 DMA、17:1 iso w9c、18:0, 16:0、cy 17:0 w7c、19:0、21:3 w3c, 处理后期出现的PLFAs主要是12:0、13:1 w5c、cy19:0 w9c、15:3 w3c、18:3 w6c、18:0 iso、19:1 w8c、14:0、14:0 iso、15:3 w3c、16:0 iso18:2 w6c、18:1 w9c、16:3 w6c、cy17:0 w7c、18:3 w6c、24:4 w6c。
在处理后期, 尤其是微米Fe/Cu与微米Fe/Cu+TX-1002组单不饱和脂肪酸(如17:1 w7c、18:1 w7c、19:3 w6c、19:1 w8c、23:3 w3c;16:3 w6c、18:3 w6c、24:4 w6c)含量明显增加, 表明真核细胞显著增加。
3 结论研究了土壤培养方式下不同零价铁还原降解土壤中OCPs污染过程中土壤微生物的变化。
(1) 在105 d的研究时间内, 还原铁粉、微米Fe/Cu、微米Fe/Cu+TX-100和空白组总PLFAs都在增加, 表示土壤中微生物总量随时间在逐渐恢复; 各处理组的各项指标均优于空白组, 说明处理组中污染物的降解有利于土壤中微生物的恢复。
(2) TX-100的毒性作用影响了微米Fe/Cu+TX-100组细菌活性, 使其总量显著少于其他组, 但投加TX-100的组提高了土壤生态缓冲能力, 促进土壤通气等性能。
(3) 通过对不同处理组PLFAs进行主成分分析, 发现处理后期加入微米Fe/Cu与加微米Fe/Cu+TX-100组原生动物显著增加。
| [1] |
SWEENY K H.American Water Works Association Research Foundation[C]//Denver, USA:Water Reuse Symposium, 1979:1487.
(  0) 0) |
| [2] |
YANG S C, LEI M, CHEN T B, et al. Application of Zero Valent Iron (Fe0) to Enhance Degradation of HCHs and DDX in Soil From a Former Organochlorine Pesticides Manufacturing Plant[J]. Chemosphere, 2010, 79(7): 727-732. DOI:10.1016/j.chemosphere.2010.02.046 (  0) 0) |
| [3] |
XIN C, Xue N D, WANG S J, et al. Reductive Dechlorination of Organochlorine Pesticides in Soils From an Abandoned Manufacturing Facility by Zero-ValentIron[J]. Science Total Environment, 2010, 408(16): 3418-3423. DOI:10.1016/j.scitotenv.2010.04.035 (  0) 0) |
| [4] |
ZHANG M, HE F, ZHAO D Y, et al. Degradation of Soil-Sorbed Trichloroethylene by Stabilized Zero Valent Iron Nanoparticles:Effects of Sorption, Surfactants, and Natural Organic Matter[J]. Water Research, 2011, 45(7): 2401-2414. DOI:10.1016/j.watres.2011.01.028 (  0) 0) |
| [5] |
宋玉芳, 周启星, 宋雪英, 等. 土壤环境污染的生态毒理学诊断方法研究进展[J]. 生态科学, 2002, 21(2): 182-186. SONG Yu-fang, ZHOU Qi-xing, SONG Xue-ying, et al. Advances in Ecotexicological Diagnosis Methods of Soil-Environmental Contamination[J]. Ecologic Science, 2002, 21(2): 182-186. (  0) 0) |
| [6] |
KNOKE K L, MARWOOD T M, CASSIDY M B, et al. A Comparison of Five Bioassays to Monitor Toxicity During Bioremediation of Pentachlorophenol-Contaminated Soil[J]. Water, Air & Soil Pollution, 1999, 110(1): 157-169. (  0) 0) |
| [7] |
晁雷, 周启星, 陈苏. 建立污染土壤修复标准的探讨[J]. 应用生态学报, 2006, 17(2): 331-334. CHAO Lei, ZHOU Qi-xing, CHEN Su. An Approach to the Establishment of Remediation Standards for Contaminated Soils[J]. Chinese Journal of Applied Ecology, 2006, 17(2): 331-334. (  0) 0) |
| [8] |
WANG S G, HOU Y L. Application of Phospholipid Fatty Acid Method in Soil Microbial Analysis[J]. Microbiology, 2004, 31(1): 114-117. (  0) 0) |
| [9] |
白震, 何红波, 张威, 等. 磷脂脂肪酸技术及其在土壤微生物研究中的应用[J]. 生态学报, 2006, 26(7): 2387-2394. BAI Zhen, HE Hong-bo, ZHANG Wei, et al. PLFAs Technique and It's Application in the Study of Soil Microbiology[J]. Acta Ecologica Sinica, 2006, 26(7): 2387-2394. (  0) 0) |
| [10] |
KAUR A, CHAUDHARY A, KAUR1 A, et al. Phospholipid Fatty Acid:A Bioindicator of Environment Monitoring and Assessment in Soil Ecosystem[J]. Current Science, 2005, 89(7): 1103-1112. (  0) 0) |
| [11] |
PRIHA O, GRAYSTON S J, HIUKKA R, et al. Microbial Community Structure and Characteristics of the Organic Matter in Soils Under Pinus sylvestris, Picea abies and Betula pendu La at Two Forest Sites[J]. Biology and Fertility of Soils, 2001, 33(1): 17-24. DOI:10.1007/s003740000281 (  0) 0) |
| [12] |
张秋芳, 刘波, 林营志, 等. 土壤微生物群落磷脂脂肪酸PLFA生物标记多样性[J]. 生态学报, 2009, 29(8): 4127-4137. ZHANG Qiu-fang, LIU Bo, LIN Ying-zhi, et al. The Diversity of Phospholipid Fatty Acid (PLFA) Biomaker for the Microbial Community in Soil[J]. Acta Ecologica Sinica, 2009, 29(8): 4127-4137. (  0) 0) |
| [13] |
宁欣强, 乔文文, 张蕾, 等. 基于磷脂脂肪酸法分析A+OSA污泥减量工艺微生物群落结构[J]. 环境工程学报, 2015, 9(10): 5024-5030. NIN Xin-qiang, QIAO Wen-wen, ZHANG Lei, et al. Microbial Community Structure of Anoxic-Oxic-Settling-Anaerobic Sludge Reduction Process Characterized by Phospholipid Fatty Acids Analysis[J]. Chinese Journal of Environmental Engineering, 2015, 9(10): 5024-5030. DOI:10.12030/j.cjee.20151065 (  0) 0) |
| [14] |
吴振斌, 王亚芬, 周巧红, 等. 利用磷脂脂肪酸表征人工湿地微生物群落结构[J]. 中国环境科学, 2006, 26(6): 737-741. WU Zhen-bin, WANG Ya-fen, ZHOU Qiao-hong, et al. Microbial Community Structure in the Integrated Vertical-Flow Constructed Wetland Utilizing Phospholipid Fatty Acids Analysis[J]. China Environment Science, 2006, 26(6): 737-741. (  0) 0) |
| [15] |
陈晓娟, 吴小红, 刘守龙, 等. 不同耕地利用方式下土壤微生物活性及群落结构特性分析:基于PLFAS和MicroRespTM方法[J]. 环境科学, 2013, 34(6): 2375-2382. CHEN Xiao-juan, WU Xiao-hong, LIU Shou-long, et al. Microbial Acticity and Community Structure Analysis Under the Different Land Use Patterns in Farmland Soils:Based on the Methods PLFA and MicroRespTM[J]. Chinese Journal Environmental Science, 2013, 34(6): 2375-2382. (  0) 0) |
| [16] |
郝建军, 姚槐应, 李先恩, 等. 磷脂脂肪酸法分析地黄根际土壤微生物多样性[J]. 土壤, 2008, 40(3): 448-454. HAO Jian-jun, YAO Huai-ying, LI Xian-en, et al. Analysis of Soil Microbial Diversity in Rehmannia glutinosa Rhizosphere With Phospholipid Fatty Acid Method[J]. Soils, 2008, 40(3): 448-454. (  0) 0) |
| [17] |
齐鸿雁, 薛凯, 张洪勋. 磷脂脂肪酸谱图分析方法及其在微生物生态学领域的应用[J]. 生态学报, 2003, 23(8): 1576-1582. QI Hong-yan, XUE Kai, ZHANG Hong-xun. Phospholipid Fatty Acid Analysis and Its Applications in Microbial Ecology[J]. Acta Ecologica Sinica, 2003, 23(8): 1576-1582. (  0) 0) |
| [18] |
FROSTEGÅRD A, TUNLID A, BÅÅTH E. Phospholipid Fatty Acid Composition, Biomass and Activity of Microbial Communities From Two Soil Types Experimentally Exposed to Different Heavy Metals[J]. Applied and Environmental Microbiology, 1993, 59(11): 3605-3617. (  0) 0) |
| [19] |
HAMEL C, VUJANOVIC V, JEANNOTTE R, et al. Negative Feedback on a Perennial Crop:Fusarium Crown and Root of Asparagus is Related to Changes in Soil Microbial Community Structure[J]. Plant and Soil, 2005, 268(1): 75-87. DOI:10.1007/s11104-004-0228-1 (  0) 0) |
| [20] |
刘智峰. 鼠李糖脂对疏水性有机污染物降解的影响研究[D]. 长沙: 湖南大学, 2012. LIU Zhi-feng.Effect of Rhamnolipids on the Degradation of Hydrophobic Organic Compounds[D].Chang sha:Hunan University, 2012. (  0) 0) |
| [21] |
郭梨锦, 曹凑贵, 张枝盛, 等. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响[J]. 农业环境科学学报, 2013, 32(8): 1577-1584. GUO Li-jin, CAO Cou-gui, ZHANG Zhi-sheng, et al. Short-Term Effects of Tillage Practices and Wheat-Straw Returned to Rice Field on Topsoil Microbial Community Structure and Microbial Diversity in Certral China[J]. Journal of Agro-Environment Science, 2013, 32(8): 1577-1584. DOI:10.11654/jaes.2013.08.013 (  0) 0) |
| [22] |
BARDGETT R D, LOVELL R D, HOBBS P J, et al. Seasonal Changes in Soil Microbial Communities Along a Fertility Gradient of Temperate Grasslands[J]. Soil Biology and Biochemistry, 1998, 31(7): 1021-1030. (  0) 0) |
| [23] |
李川, 禹媛, 万金忠, 等. 土壤污染的修复方法研究:以表面活性剂强化微米Fe/Cu对有机氯农药的降解为例[J]. 地球学报, 2015, 36(4): 493-499. LI Chuan, YU Yuan, WAN Jin-zhong, et al. The Remediation Method for Contaminated Soil:A Case Study of Degradation of Organochlorine Pesticides by Surfactant-Enhanced Fe/Cu Bimetallic System[J]. Acta Geoscientica Sinica, 2015, 36(4): 493-499. DOI:10.3975/cagsb.2015.04.12 (  0) 0) |
| [24] |
HAMMESFAHR U, HEUER H, MANZKE B, et al. Impact of the Antibiotic Sulfadiazine and Pig Manure on the Microbial Community Structure in Agricultural Soils[J]. Soil Biology and Biochemistry, 2008, 40(7): 1583-1591. DOI:10.1016/j.soilbio.2008.01.010 (  0) 0) |
| [25] |
时鹏, 王淑平, 贾书刚, 等. 三种种植方式对土壤微生物群落组成的影响[J]. 植物生态学报, 2011, 35(9): 965-972. SHI Peng, WANG Shu-ping, JIA Shu-gang, et al. Effects of Three Planting Patterns on Soil Microbial Community Composition[J]. Chinese Journal of Plant Ecology, 2011, 35(9): 965-972. (  0) 0) |
| [26] |
滕应, 徐莉, 邹德勋, 等. 多氯联苯复合污染土壤的微生物群落结构多样性变化[J]. 生态环境, 2007, 16(6): 1688-1693. TENG Ying, XU Li, ZOU De-xun, et al. Changes of Soil Microbial Structural Diversity in Polychlorinated Biphenyls Mixed Polluted Soils[J]. Ecology and Environment, 2007, 16(6): 1688-1693. (  0) 0) |




