2. 南京理工大学化工学院, 江苏 南京 210094
2. College of Chemical Engineering of Nanjing University of Science & Technology, Nanjing 210094, China
水体富营养化是当今重要的环境问题之一。其中, 氮是诱发水体富营养化的重要因子[1-3]。在大多数控制和修复富营养化水体的生态工程中, 如人工湿地、植物缓冲带、生态浮床等, 水生植物是不可缺少的部分。水生植物生态修复工程具有投资和维护成本低、操作简单、效果稳定、不易造成二次污染等生态和经济双重效益[4-6]。
由于不同类型水生植物的生长特性不同, 对水体中氮的吸收利用能力、强度和作用方式具有较大差异, 这会造成以不同类型水生植物为核心的生态修复工程对污水的净化效果具有较大差异。以往的研究中水生植物对水体氮迁移转化的影响一直备受关注, 但更多的是评价整个净化系统的氮去除过程, 而对不同类型水生植物的贡献, 尤其对短时间内植物对水体中无机氮吸收、转化的影响研究较少[7-9]。这不利于在实际应用中合理选取水生植物类型并进一步提高水生植物生态净化污水工程的效率。
除了挺水植物之外, 漂浮植物、浮叶植物、沉水植物也是富营养化水体生态修复工程中常用的植物类型。其中, 漂浮植物根系悬浮于水中生长, 从上覆水体中直接吸收养分, 与底泥养分的交互作用较小, 其覆盖水面可能造成好氧-厌氧的环境, 利于硝酸盐的还原[10]; 沉水植物根系扎根于底泥, 茎叶完全浸没于水下, 其光合作用可能使水体溶解氧饱和甚至过饱和, 有利于水体中氨氮的氧化[11]; 而浮叶植物既有茎叶覆盖水面, 又有根系扎根底泥。因此, 不同类型水生植物对水体中氮的转化、吸收和净化效率可能具有较大差异。另外, 水生植物在不同生长阶段对水体氮吸收的能力和效率具有较大差异[12]。除了植物吸收作用, 水体中微生物驱动的生物脱氮反应将部分氮转化为气态N2O、N2, 这也是减缓富营养化水体中N负荷过量的重要途径之一[13]。不同类型水生植物调节水体中微生物脱氮过程的强度亦有所不同。
针对以上分析, 为更好地揭示不同类型水生植物对氮吸收、转化和去除的能力, 选取不同水生植物为供试植物, 构建水体净化系统, 在植物生长初期、快速生长期、缓慢生长期研究其吸收富集氮能力、去除水体中氮效率及对水体生物脱氮过程的影响, 以期为其在富营养化水体治理中推广应用提供参考依据。
1 材料与方法 1.1 试验材料选取不同类型且生长良好的代表性植物凤眼莲(Eichhornia crassipes)、大薸(Pistia stratiotes)、乌菱(Trapa bicornis)和轮叶黑藻(Hydrilla verticillata)作为试验物种。凤眼莲采自江苏省农业科学院2#富营养化蓄水塘, 大薸为网上购得种苗进行培养, 乌菱为自行买种并在试验器皿里育种, 轮叶黑藻采自江苏省农业科学院六合基地养鱼塘。
抽取江苏省农业科学院2#塘的生活污水, 泵入配水池中, 向水中加入一定量NH4NO3和KH2PO4, 配制成ρ(TN)为20 mg·L-1、ρ(TP)为1.5 mg·L-1的富营养化水体。
1.2 试验设计试验设5个处理, 包括未种水生植物的对照和种植4种不同类型水生植物的处理, 每个处理4次重复, 采用随机区组设计。试验于2014年6月开始, 在20个圆柱形不锈钢水池(深1.5 m, 内径1.2 m)内构建水生植物净化系统。
试验开始前在每个水池内铺设20 cm厚的湿润塘泥, 约360 kg。同时, 从温棚中选取20株预先培育发芽的乌菱和轮叶黑藻幼苗移栽进入相应水池的底泥中, 加入约20 cm深自来水培育1周, 并去除长势欠佳的植株, 补进长势良好的幼苗。幼苗生长恢复1周后试验正式开始, 将每个水池培育幼苗的用水排干, 然后泵入配好的富营养化水体至距水池上沿25 cm处, 平衡24 h。在每个处理中布置集气装置, 收集水体中释放的生物脱氮气体。
整个试验共分为3个阶段:生长初期(6月8日—7月7日)、快速生长期(7月19日—9月3日)和缓慢生长期(9月16日—9月26日)。每个阶段结束后更换富营养化水体, 试验期间用自来水补充蒸腾和蒸发损失的水分。
试验初期每隔1 d采集1次水样, 后期根据N、P浓度变化幅度适当调整, 每隔2~4 d采集1次水样。每个阶段开始和结束时采集植物样, 称量生物量(以鲜重计), 烘干后测定植株体内氮含量。
采用自主研发的气体收集装置定期收集释放的气体[14-16], 测定气体释放总量、N2和N2O的释放通量。晴天每2 d采集1次气体, 阴雨天适当延长气体采集间隔。
1.3 分析方法植物样TN含量采用浓H2SO4-H2O2消解法测定; 水体TN浓度采用碱性过硫酸钾消解紫外分光光度法测定; 水体NO3--N、NH4+-N浓度采用SKALAR SAN++型流动分析仪(荷兰)测定; 水体释放气体的装置、收集方法及气体样品的测定方法详见文献[14-16]。
1.4 数据处理采用Excel 2010和SPSS 20.0软件进行数据整理和重复测量方差分析, Sigmaplot 12.5软件作图。
2 结果与分析 2.1 不同类型水生植物对各形态氮去除效率的影响从图 1可见, 水体中NH4+-N浓度在各试验阶段初期迅速下降, 后趋于平缓。3个生长阶段凤眼莲去除水中氨氮的效率均最高, 每个阶段开始后7 d内水体NH4+-N浓度分别下降83.5%、99.4%和78.3%, 乌菱与轮叶黑藻去除水体NH4+-N的效率显著低于凤眼莲和大薸(P<0.05), 轮叶黑藻的去除效率均最低。除凤眼莲外, 其他3种类型水生植物均表现出生长初期阶段NH4+-N净化效率最高的趋势。
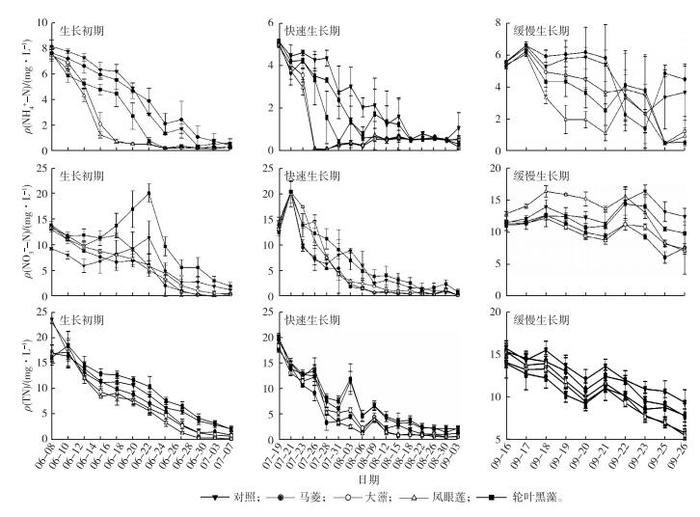
|
图 1 不同生长阶段水生植物处理水体中NH4+-N、NO3--N和TN浓度变化 Figure 1 Variation of NH4+-N, NO3--N and TN concentrations in water with type of aquatic plants |
后2个生长阶段凤眼莲去除水体中NO3--N效率均最高, 10 d内水体NO3--N浓度分别下降71.44%和45.24%, 初期生长阶段乌菱与凤眼莲对水体中NO3--N的去除效率无显著差异。3个生长阶段轮叶黑藻的NO3--N去除效率均最低。4种不同类型水生植物快速生长阶段对NO3--N净化效率最高。
2.2 不同类型水生植物生物量变化及对水体氮的吸收富集作用3个生长阶段植物生物量变化如表 1所示。其中凤眼莲生物量累积最大, 大薸次之, 轮叶黑藻最少。不同生长阶段相比, 快速生长阶段各植物生物量累积最多。
|
|
表 1 不同类型水生植物不同生长阶段的生物量变化 Table 1 Variation of biomass of the aquatic plants relative to type and growth stage |
3个生长阶段植物体内TN含量变化如表 2所示。同一生长阶段不同植物体内TN含量的增加表现出显著差异。凤眼莲富集氮最多, 大薸次之。不同生长阶段相比, 快速生长期各植物富集氮均最多。
|
|
表 2 不同类型水生植物不同生长阶段体内富集的氮量 Table 2 Nitrogen enrichment of the aquatic plants relative to type and growth stage |
不同类型水生植物单位生物量对水体氮的去除率如表 3所示, 轮叶黑藻单位生物量对水体氮的去除率显著高于其他植物, 乌菱次之, 凤眼莲和大薸间无显著差异(P>0.05)。
|
|
表 3 不同类型水生植物不同生长阶段单位生物量对水体总氮的去除率 Table 3 Nitrogen removal rate per unit biomass of the aquatic plant relative to type and growth stage |
如表 4所示, 种植大薸和凤眼莲的水体气体释放总量较小, 种植轮叶黑藻、乌菱的水体气体释放总量显著高于漂浮植物大薸(P<0.05)。
|
|
表 4 快速生长阶段各处理气体的释放总量和通量 Table 4 Total volume and flux of gases produced at the rapid growth stage of the plants |
4种水生植物相比, 种植轮叶黑藻的水体N2O的释放通量最高, 凤眼莲与乌菱次之, 而大薸最小。N2的释放通量中, 种植乌菱的水体最高, 轮叶黑藻与其差异不显著(P>0.05);种植大薸的水体N2的释放通量显著低于其他水生植物(P < 0.05)。
3 讨论不同类型的水生植物去除水体氨氮、硝态氮和总氮的效率具有差异。凤眼莲和大薸在3个生长阶段对各种形态氮的去除效率均最高。这主要是因为漂浮植物根系发达[17], 悬浮在水中生长, 能快速从水中吸收营养元素, 并能吸收低浓度氮[18]。凤眼莲可在低至0.05 mg·L-1氨氮或硝态氮条件下正常生长和繁殖[19-20], 当供氮水平在0.5~5.5 mg·L-1范围时, 其富集氮量与供氮水平存在明显的正相关关系[21-22]。不同研究对凤眼莲吸收水体中氮的速率的报道不尽相同(416~2 316 mg·m-2·d-1)[23-25], 但与其他水生植物相比较, 其吸收氮的速率和富集能力均较为突出。试验结束时, 凤眼莲处理水体中各形态氮的浓度最低, 也表明凤眼莲对水体氮的吸收效果最好。其他研究中凤眼莲也表现出最优的氮净化效率。例如, 在用凤眼莲、黄花水龙(Ludwigia peploides)、空心莲子草(Alternanthera philoxeroides)、水鳖(Hydrocharis dubia)和浮萍(Lemna minor)5种水生植物治理生活污水时, 凤眼莲除氮率最高, 空心莲子草最低, 浮萍对硝态氮的去除率和凤眼莲相当[26]。
早在19世纪80年代, 部分学者就提出可以利用凤眼莲处理污水处理厂和牲畜饲喂厂的污水[26-29], 因为凤眼莲具有强大的繁殖能力, 其根系能够从水体中直接、大量吸收所需氮。笔者试验中, 凤眼莲也是生物量积累最快的植物。适宜条件下, 1株凤眼莲可在50 d内长成3 000株, 1 a内覆盖600 m2的面积[30-31]。凤眼莲的迅速繁殖需要从水体中吸收大量氮用以合成其结构物质, 因此对水体氮的去除效率明显优于其他水生植物。大薸同为漂浮植物, 与凤眼莲具有相同的特性, 去除水体氮的速度与凤眼莲相近, 但其生物量的增加不及凤眼莲快, 因此植株体内富集的氮量低于凤眼莲。轮叶黑藻可通过根茎叶吸收营养物质, 在昆明滇池进行的模拟试验表明, 凤眼莲同化作用带走的氮量是轮叶黑藻同化氮量的1.2倍[32]。
不同类型水生植物对水体中氮的利用方式差异较大。沉水植物、浮叶植物一般从沉积物孔隙水中吸收氮, 而很少直接利用上覆水中氮, 它们通常在浅水水域或滨岸水域生长。沉水植物轮叶黑藻根扎于底泥, 主要从底泥中吸收营养来维持生长[33], 对水中氮的去除效率不如漂浮植物。笔者试验中轮叶黑藻生物累积量少, 单位生物量对氮的去除率最高, 其对修复富营养化水体的作用不可小觑, 但是沉水植物对水体环境非常敏感, 要求水体氮磷浓度不能太高,风浪不能过大,水深不能过深,以免影响光合作用等, 在某种程度上限制了其在富营养化水体生态修复中的应用[34]。笔者试验过程中天气状况差,水体透明度低, 对沉水植物的生长产生不利影响[35-37]。浮叶植物乌菱的茎上长有大量须根, 能直接吸收水中的氮。因此, 乌菱在生长初期氮的去除率优于沉水植物。但是, 乌菱的生长期比较短, 8月乌菱果实成熟时植株迅速进入衰退期, 对水的净化效率迅速下降。
3个生长阶段相比, 快速生长期各类植物净化水体氮的速率最快, 其次是生长初期。生长初期虽然植物对养分的需求量大, 但是由于该阶段未达到水生植物最适宜生长温度, 植物生长速率较低, 所以净化水体氮的速率也较低。快速生长期的温度接近水生植物的最适生长温度(一般为30 ℃), 生物量增加快, 吸收净化水体氮效率高, 微生物驱动的氮生物转化过程也比较强烈。乌菱在8月果实收获, 在几种植物中最先进入生长衰退期。在亚热带地区, 凤眼莲可生长至11月。而一些沉水植物, 如马来眼子菜(Potamogeton malainus)、黑藻(Hydrilla verticillata)、金鱼藻(Ceratophyllum demersum)、狐尾藻(Myriophyllum verticillatum)等, 可以在深秋初冬生长, 且能保持良好的污水处理效果[38]。
各类水生植物对水体生物脱氮过程的调节作用也具有明显差异。种植轮叶黑藻的水体释放N2O和N2通量显著高于其他水生植物。轮叶黑藻在水体中生长的茎叶能够形成生物膜, 为各类微生物的生长和繁殖提供良好的附着表面[39], 可在一定程度上促进水中的反硝化作用和N2的释放。同时, 由于沉水植物需要在水体中进行光合作用, 轮叶黑藻体内的氧气在通气组织中扩散, 在根区形成好氧-厌氧界面[40-41], 形成氧化-还原微环境, 促使底泥中硝化、反硝化过程的发生。乌菱扎在底泥中的根系同样具有促进硝化、反硝化脱氮过程的潜力, 故乌菱释放气体总量略高于漂浮植物。大型水生植物发达的根系分泌丰富的有机碳, 能够为水体反硝化及其他微生物提供充足的有机碳源, 从而促进反硝化反应过程[42]。但是种植漂浮植物的水体释放N2和N2O通量以及气体释放总量均低于其他2类水生植物, 可能是由于试验期间水体无外源氮的补充, 漂浮植物生物量增长快、吸收水体氮的效率高, 与硝化反硝化微生物竞争氮源, 使硝化、反硝化反应过程缺少底物, 削弱了生物脱氮作用。
虽然轮叶黑藻单位生物量对水体氮的去除率较高, 但其茎叶脆弱, 在几种植物中最容易受损, 须根发达且细弱, 是人工或机械收获难度最大的植物。乌菱茎在水体中缠绕, 根扎入水中, 难以实现机械收获, 但是乌菱作为一种经济作物, 可入药或加工为食物, 具有极高的经济价值。凤眼莲与大薸易于收获, 不会造成二次污染。尽管凤眼莲具有超强的净化水质的能力, 但由于其在污染水体中生长迅速, 管理上稍有疏忽就会引发生态灾害。因此, 在应用凤眼莲修复污染水体的实际工程中, 必须对其进行严格控制, 并定期打捞和收集。凤眼莲营养成分丰富, 开发利用前景极其广阔, 目前已被应用于制作饲料[43]、堆制肥料[44]、发酵产沼气[45-46]以及食品、药用资源的开发等。
4 结论4种不同类型水生植物相比较, 漂浮植物凤眼莲和大薸对水中氮的净化效率最高,效果最好。浮叶植物乌菱在生长初期及快速生长期净化水体氮的效果优于沉水植物, 但8月下旬进入果实成熟期后, 乌菱对水体的净化能力迅速下降。
种植沉水植物轮叶黑藻的水体气体释放总量及N2和N2O释放通量较其他3种水生植物高, 说明沉水植物介导下的生物脱氮过程对净化上覆水体中的过量氮具有不可忽视的贡献。
不同水生植物具有各自独特的优势, 可根据生态工程实践目的进行合理选择:凤眼莲易于收获, 是一种经济高效环保的优势物种, 但在管理上必须对其进行严格控制, 并定期打捞和收集。大薸净化富营养化水体能力仅次于凤眼莲。乌菱难以实现机械收获, 具有极高的经济价值。轮叶黑藻单位生物量去除水体氮的效率最高, 但其生长易受限制, 茎叶脆弱, 是收获难度最大的植物。
| [1] |
HECKY R E, KIHAM P. Nutrient Limitation of Phytoplankton in Freshwater and Marine Environments:A Review of Recent Evidence on the Effects of Enrichment[J]. Limnology and Oceanography, 1988, 33(4): 796-822. (  0) 0) |
| [2] |
NIXON S W. Coastal Marine Eutrophication:A Definition, Social Causes, and Future Concerns[J]. Ophelia, 1995, 41(1): 199-219. DOI:10.1080/00785236.1995.10422044 (  0) 0) |
| [3] |
SCHINDLER D W, HECKY R E, FINDLAY D L, et al. Eutrophication of Lakes Cannot be Controlled by Reducing Nitrogen Input:Results of a 37-Year Whole-Ecosystem Experiment[J]. Proceedings of the National Academy of Sciences, 2008, 105(32): 11254-11258. DOI:10.1073/pnas.0805108105 (  0) 0) |
| [4] |
张艺, 许文年, 方艳芬, 等. 三峡库湾香溪河生态环境研究进展[J]. 三峡大学学报(自然科学版), 2007, 29(1): 20-24. ZHANG Yi, XU Wen-nian, FANG Yan-fen, et al. Advance in Research on Ecological Environment of Xiangxi River of Three Gorges Reservoir Area[J]. Journal of China Three Gorges University(Natural Sciences), 2007, 29(1): 20-24. (  0) 0) |
| [5] |
刘盼, 宋超, 朱华, 等. 3种水生植物对富营养化水体的净化作用研究[J]. 水生态学杂志, 2011, 32(2): 69-74. LIU Pan, SONG Chao, ZHU Hua, et al. Studies on Eutrophicated Water Quality Improvement by Three Kinds of Hydrophytes[J]. Journal of Hydroecology, 2011, 32(2): 69-74. (  0) 0) |
| [6] |
李安峰, 潘涛, 杨冲, 等. 水体富营养化治理与控制技术综述[J]. 安徽农业科学, 2012, 40(16): 9041-9044, 9062. LI An-feng, PAN Tao, YANG Chong, et al. Review of the Treatment and Control Techniques of Water Eutrophication[J]. Journal of Anhui Agricultural Sciences, 2012, 40(16): 9041-9044, 9062. DOI:10.3969/j.issn.0517-6611.2012.16.095 (  0) 0) |
| [7] |
魏晓慧, 冯佳, 谢树莲, 等. 六种水生植物对汾河太原段污水的修复研究[J]. 给水排水, 2012(增刊1): 102-105. WEI Xiao-hui, FENG Jia, XIE Shu-lian, et al. Study on Restoration in Taiyuan Segment of Fenhe River by Six Aquatic Plants[J]. Journal of Water Supply and Drainage, 2012(Suppl.1): 102-105. (  0) 0) |
| [8] |
高丁梅, 杨涓, 虎春宇, 等. 宁夏4种水生植物对富营养化水体净化效果的研究[J]. 农业科学研究, 2012, 33(2): 63-65. GAO Ding-mei, YANG Juan, HU Chun-yu, et al. Study on the Effect of Purification of Four Aquatic Macrophytes to the Eutrophic Water in Ningxia[J]. Journal of Agricultural Sciences, 2012, 33(2): 63-65. (  0) 0) |
| [9] |
FRASER L H, CARTY S M, STEER D. A Test of Four Plant Species to Reduce Total Nitrogen and Total Phosphorus From Soil Leachate in Subsurface Wetland Microcosms[J]. Bioresource Technology, 2004, 94(2): 185-192. DOI:10.1016/j.biortech.2003.11.023 (  0) 0) |
| [10] |
高岩, 易能, 张志勇, 等. 凤眼莲对富营养化水体硝化、反硝化脱氮释放N2O的影响[J]. 环境科学学报, 2012, 32(2): 349-359. GAO Yan, YI Neng, ZHANG Zhi-yong, et al. Effect of Water Hyacinth on N2O Emission Through Nitrification and Denitrification Reactions in Eutrophic Water[J]. Acta Scientiae Circumstantiae, 2012, 32(2): 349-359. (  0) 0) |
| [11] |
王娟, 王圣瑞, 金相灿, 等. 沉水植物黑藻对沉积物氨氮吸附/释放特征的影响[J]. 生态环境, 2007, 16(2): 336-341. WANG Juan, WANG Sheng-rui, JIN Xiang-can, et al. Effect of Submerged Aquatic Plant Hydrilla verticilla on the Sorption/Release Characteristic of Ammonia Nitrogen on Sediment[J]. Ecology and Environment, 2007, 16(2): 336-341. (  0) 0) |
| [12] |
马涛, 易能, 张振华, 等. 凤眼莲根系分泌氧和有机碳规律及其对水体氮转化影响的研究[J]. 农业环境科学学报, 2014, 33(10): 2003-2013. MA Tao, YI Neng, ZHANG Zhen-hua, et al. Oxygen and Organic Carbon Releases From Roots of and Eichhonia crassipes and Their Influence on Transformation of Nitrogen in Water[J]. Journal of Agro-Environmental Science, 2014, 33(10): 2003-2013. DOI:10.11654/jaes.2014.10.018 (  0) 0) |
| [13] |
马涛, 张振华, 易能., 等. 凤眼莲及底泥对富营养化水体反硝化脱氮特征的影响研究[J]. 农业环境科学学报, 2013, 32(12): 2451-2459. MA Tao, ZHANG Zhen-hua, YI Neng, et al. Nitrogen Removal Via Denitrification From Eutrophic Water as Influenced by Eichhonia crassipes and Sediment[J]. Journal of Agro-Environmental Science, 2013, 32(12): 2451-2459. DOI:10.11654/jaes.2013.12.019 (  0) 0) |
| [14] |
GAO Y, LIU X H, YI N, et al. Estimation of N2 and N2O Ebullition From Eutrophic Water Using an Improved Bubble Trap Device[J]. Ecological Engineering, 2013, 57: 403-412. DOI:10.1016/j.ecoleng.2013.04.020 (  0) 0) |
| [15] |
刘新红, 严少华, 张志勇, 等. 一种水体底泥释放气体的收集装置. 中国专利, 201220549038. 0[P]. 2012-12-25. LIU Xin-hong, YAN Shao-hua, ZHANG Zhi-yong, et al.A Device Trapping Ebullition From Sediment.China Patent, 201220549038.0[P].2012-12-25. (  0) 0) |
| [16] |
高岩, 刘新红, 马涛, 等. 水体释放气体的研究: 收集装置描述及收集气体成分研究[C]//第五届全国农业环境科学学术研讨会论文集. 天津: 中国农业生态环境保护协会, 2013: 578-586. GAO Yan, LIU Xin-hong, MA Tao, et al.A Device Trapping Ebullition From Water Body:Device Description and Gas Composition Studies[C]//The Proceedings the 5th National Conference of Agro-environment Science, Tianjin:Chinese Society of Agro-Ecolo gical Environment Protection, 2013:578-586. (  0) 0) |
| [17] |
张迎颖, 吴富勤, 张志勇, 等. 凤眼莲有性繁殖与种子结构及其活力研究[J]. 南京农业大学学报, 2012, 35(1): 135-138. ZHANG Ying-ying, WU Fu-qin, ZHANG Zhi-yong, et al. Research on Sexual Reproduction, Seed Structure and its Vigor of Eichhornia crassipes[J]. Journal of Nanjing Agricultural University, 2012, 35(1): 135-138. DOI:10.7685/j.issn.1000-2030.2012.01.024 (  0) 0) |
| [18] |
常会庆, 李娜, 徐晓峰. 三种水生植物对不同形态氮素吸收动力学研究[J]. 生态环境, 2008, 17(2): 511-514. CHANG Hui-qing, LI Na, XU Xiao-feng. NH4+ and NO3- Uptake Kinetics of Three Aquatic Macrophytes[J]. Ecology and Environment, 2008, 17(2): 511-514. (  0) 0) |
| [19] |
SHIRALIPOUR A, GARRARD L A, HALLER W T. Nitrogen Source, Biomass Production, and Phosphorus Uptake in Water Hyacinth[J]. Journal of Aquatic Plant Managent, 1981, 19: 40-43. (  0) 0) |
| [20] |
TUCKER C S. The Effect of Ionic Form and Level of Nitrogen on the Growth and Composition of Eichhornia crassipes (Mart.) Solms[J]. Hydrobiologia, 1981, 83(3): 517-522. DOI:10.1007/BF02187049 (  0) 0) |
| [21] |
REDDY K R, AGAMI M, TUKER J C. Influence of Nitrogen Supply Rates on Growth and Nutrient Storage by Water Hyacinth (Eichhornia crassipes) Plants[J]. Aquatic Botany, 1989, 36(1): 33-43. DOI:10.1016/0304-3770(89)90089-2 (  0) 0) |
| [22] |
FOX L J, STRUIK P C, APPLETON B L, et al. Nitrogen Phytoremediation by Water Hyacinth (Eichhornia Crassipes (Mart.) Solms)[J]. Water, Air, and Soil Pollution, 2008, 194(1): 199-207. (  0) 0) |
| [23] |
TRIPATHI B D, SRIVASTAVA J, MISRA K. Nitrogen and Phosphorus Removal-Capacity of Four Chosen Aquatic Macrophytes in Tropical Freshwater Ponds[J]. Environmental Conservation, 1991, 18(2): 143-147. DOI:10.1017/S037689290002172X (  0) 0) |
| [24] |
SHARMA B M, OSHODI O O. Effect of Nutrients on the Biomass of Water Hyacinth (Eichhornia Crassipes (Mart) Solms)[J]. Polskie Archiwum Hydrobiolog, 1992, 38: 401. (  0) 0) |
| [25] |
ŽKOVZ, PALÁTM, KOCKOVÁE, 等. Is It Realistic to Use Water Hyacinth for Wastewater Treatment and Nutrient Removal in Central Europe?[J]. Water Science and Technology, 1994, 30(8): 303-311. (  0) 0) |
| [26] |
舒柳. 5种水生植物对净化生活污水的效果研究[J]. 广东农业科学, 2013, 40(6): 161-163. SHU Liu. Research of Different Aquatic Plants on Purify the Domestic Sewage[J]. Guangdong Agricultural Sciences, 2013, 40(6): 161-163. (  0) 0) |
| [27] |
CORNWELL D A, ZOLTRK JR J, PATRINELY C D, et al. Nutrient Removal by Water Hyacinths[J]. Journal Water Environment Federation, 1977, 49(1): 57-65. (  0) 0) |
| [28] |
ROGERS H H, DAVIS D E. Nutrient Removal by Waterhyacinth[J]. Weed Science, 1972, 20(5): 423-428. (  0) 0) |
| [29] |
WOLVERTON B C, MCDONALD R C. Water Hyacinths for Upgrading Sewage Lagoons to Meet Advanced Wastewater Treatment Standards:Part Ⅱ[M]. Bay Saint Louis, USA: NASA Technical Memorandum, 1976, 1-24.
(  0) 0) |
| [30] |
GUTIÉRREZ E, HUERTO R, SALDAÑA P, et al.Strategies for Waterhyacinth (Eichhornia crassipes) Control in Mexico[M]//CAFFREY J M, BARRETT P R F, MURPHY K J.Management and Ecology of Freshwater Plants.Berlin, Germany:Springer, 1996:181-185.
(  0) 0) |
| [31] |
MADSEN J D. Growth and Biomass Allocation Patterns During Water hyacinth Mat Development[J]. Journal of Aquatic Plant Management, 1993, 31: 134-137. (  0) 0) |
| [32] |
闫芊. 沉水植物黑藻在水生生态系统修复中的应用研究[J]. 环境与发展, 2013(8): 94-96. YAN Qian. Study on Application of Submerged Plant Hydrilla verticillata in Aquatic Ecosystem Restoration[J]. Environment and Development, 2013(8): 94-96. (  0) 0) |
| [33] |
徐寸发, 张志勇, 秦红杰, 等. 不同生活型水生植物改善滇池草海水体的效果[J]. 江苏农业科学, 2015, 43(6): 307-311. XU Cun-fa, ZHANG Zhi-yong, QIN Hong-jie, et al. The Purification Effects Among Three Different Living Kinds of Aquatic Plants in Water Body of Lake Dianchi Caohai[J]. Jiangsu Agricultural Sciences, 2015, 43(6): 307-311. (  0) 0) |
| [34] |
秦伯强. 湖泊生态恢复的基本原理与实现[J]. 生态学报, 2007, 27(11): 4848-4858. QIN Bo-qiang. Principles and Approach for Lake Ecological Restoration[J]. Acta Ecologica Snica, 2007, 27(11): 4848-4858. DOI:10.3321/j.issn:1000-0933.2007.11.055 (  0) 0) |
| [35] |
MCJANET C L, KEDDY P A, PICK F R. Nitrogen and Phosphorus Tissue Concentration in 41 Wetland Plants:A Comparison Across Habitats and Functional Groups[J]. Functional Ecology, 1995, 9(2): 231-238. DOI:10.2307/2390569 (  0) 0) |
| [36] |
TANNER C C. Plants for Constructed Wetland Treatment Systems:A Comparison of the Growth and Nutrient Uptake of Eight Emergent Species[J]. Ecological Engineering, 1996, 7(1): 59-83. DOI:10.1016/0925-8574(95)00066-6 (  0) 0) |
| [37] |
HEADLEY T R.Removal of Nutrients and Plant Pathogens From Plants Nursery Runoff Using Horizontal Subsurface Flow Constructed Wetlands[D].Lismore, Australia:Southem Cross University, 2004.
(  0) 0) |
| [38] |
邹国林, 王全金, 朱平, 等. 低温下沉水植物塘对农村污染水体的净化作用[J]. 武汉工程大学学报, 2012, 34(3): 38-41. ZOU Guo-lin, WANG Quan-jing, ZHU Ping, et al. Purification Function of Submerged Plant Pond in Rural Polluted Water at Low Temperature[J]. Journal of Wuhan Institute of Technology, 2012, 34(3): 38-41. (  0) 0) |
| [39] |
李聪聪, 吴振东, 周青, 等. 植物-微生物共代谢系统在湖泊修复中的作用[J]. 上海环境科学, 2012(6): 240-244, 248. LI Cong-cong, WU Zhen-dong, ZHOU Qing, et al. Effects of the Plant-and-Microorganism Co-Metabolic System on Lake Remediation[J]. Shanghai Environmental Science, 2012(6): 240-244, 248. (  0) 0) |
| [40] |
REDDY K R, PATRICK W H, LINDAU C W. Nitrification-Denitrification at the Plant Root-Sediment Interface in Wetlands[J]. Limnology Oceanography, 1989, 34(6): 1004-1013. DOI:10.4319/lo.1989.34.6.1004 (  0) 0) |
| [41] |
SCHULZ M, KOZERSKI H P, PLUNTKE T, et al. The Influence of Macrophytes on Sedimentation and Nutrient Retention in the Lower River Spree(Germany)[J]. Water Research, 2003, 37(3): 569-578. DOI:10.1016/S0043-1354(02)00276-2 (  0) 0) |
| [42] |
CARPENTER S R, LODGER D M. Effects of Submersed Macrophytes on Ecosystem Process[J]. Aquatic Botany, 1986, 26(3/4): 341-370. (  0) 0) |
| [43] |
MUKHERJEE R, NANDI B. Improvement of in Vitro Digestibility Through Biological Treatment of Water Hyacinth Biomass by Two Pleurotus Species[J]. International Biodeterioration & Biodegradation, 2004, 53(1): 7-12. (  0) 0) |
| [44] |
ADEOYE G O, SRIDHAR M K C, IPINMOROTI R R. Potassium Recovery From Farm Wastes for Crop Growth[J]. Communications in Soil Science and Plant Analysis, 2001, 32(15/16): 2347-2358. (  0) 0) |
| [45] |
PATVEEN S, FEROZA B, HOSSAIN M, et al. Production of Biogas From Cow Dung by Adding Water Hyacinth and Mud[J]. Bangladesh Journal of Scientific and Industrial Research, 1998, 33(3): 369-372. (  0) 0) |
| [46] |
MATSUMURA Y. Evaluation of Supercritical Water Gasification and Biomethanation for Wet Biomass Utilization in Japan[J]. Energy Conversion and Management, 2002, 43(9): 1301-1310. (  0) 0) |




