2. 江苏省环境演变与生态建设重点实验室, 江苏 南京 210023
2. Jiangsu Key Laboratory of Environmental Change and Ecological Construction, Nanjing 210023, China
过硫酸盐氧化技术是近年来新兴的一种高级氧化技术。过硫酸盐本身氧化能力有限, 但在一定条件下可以活化生成强氧化性的硫酸根自由基, 通过电子转移等反应实现污染物的高效降解去除。研究表明, 光[1]、热[2]和过渡金属离子[3]等都可以活化过硫酸盐产生硫酸根自由基。但是, 光、热等活化法需外加能量, 而过渡金属离子活化则存在反应后金属离子的二次污染问题。
生物炭是生物质在缺氧或少氧条件下热解生成的一种含碳量高的固体碳化物质。它可以改善土壤结构, 增加土壤肥力, 提高作物产量[4-5]。生物炭对重金属[6-7]和有机物[8-9]也有一定的吸附能力, 可用于污染土壤修复。FANG等[10]研究发现, 生物炭可以活化过硫酸盐用于有机污染物的降解。与其他过硫酸盐活化剂相比, 生物炭性质稳定, 反应无需外加能量, 也无金属离子引入, 在废水、地下水及土壤有机污染物的治理方面具有广阔的应用前景。
20世纪90年代以来, 我国淡水水体富营养化日趋严重, 太湖、巢湖、滇池等先后暴发了严重的蓝藻水华, 蓝藻在富营养化水体中迅速繁殖, 水体透明度下降, 水体功能遭到破坏。蓝藻水华的生物量巨大, 以太湖沿岸的无锡市为例, 蓝藻生长高峰期每天的打捞量高达上千吨。蓝藻不能直接被家禽、家畜食用, 大量打捞的蓝藻得不到及时有效的处理, 长期堆积导致腐烂发臭, 分解释放大量氮、磷等营养盐颗粒, 硫化氢气体和微囊藻毒素等有害物质, 对环境造成二次污染[11]。蓝藻是一种优良的生物质原料, 如果将它制备成生物炭, 再将生物炭作为过硫酸盐活化剂用于染料等难降解污染物的去除, 不仅可以为蓝藻的资源化利用提供一个新的途径, 而且可以为过硫酸盐氧化技术提供一种价廉易得的活化剂。目前, 相关研究鲜有报道。
因此, 笔者选取蓝藻为原料, 在不同条件下制备多种生物炭, 在对蓝藻生物炭物化性质进行表征的基础上, 以偶氮染料橙黄G作为典型有机污染物, 研究制备条件对生物炭活化过硫酸盐效能的影响, 分析降解过程的影响因素及活化机理, 并对其再生利用性能进行评价, 以期为蓝藻生物炭在活化过硫酸盐高级氧化技术中的应用提供科学依据与技术支撑。
1 材料与方法 1.1 材料与仪器蓝藻取自太湖月亮湾, 水稻秸秆购自南京当地农家, 2种材料去除杂质、洗净、烘干备用。
磷酸、氢氧化钠、过硫酸钠(PS)购自南京化学试剂有限公司。甲醇购自德国默克公司。硫酸和橙黄G购自国药集团化学试剂有限公司。橙黄G(C16 H10 N2Na2O7S2)的分子结构为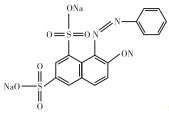
将烘干后的蓝藻粉碎, 用7.3 mol·L-1磷酸或氢氧化钠溶液浸渍8 h, 然后转移至马弗炉中, 在设定温度条件下热解1 h, 冷却后用去离子水清洗至滤出液为中性, 烘干, 研磨后过150 μm孔径筛, 备用。将采用磷酸和氢氧化钠预处理后得到的生物炭分别命名为CHB和CNB。水稻秸秆生物炭的制备参照文献[12], 热解温度为500 ℃, 将得到的生物炭命名为RSB。
1.3 生物炭的表征采用Vario EL Ⅲ元素分析仪(德国元素分析系统公司)测定C、H、N、S这4种元素的质量含量。采用Autosorb iQ比表面积与孔径分析仪(美国康塔公司)分析生物炭的孔径结构, 在77 K条件下测定生物炭对氮气的吸附/脱附等温线, 由BET(Brunauer-Emmett-Teller)法计算总比表面积(SBET), 采用系统软件(Quantachrome Instruments Version 2.0)计算总孔容(Vt)和平均孔径(Ap), 由t-plot法计算微孔孔容(Smic)和微孔比表面积(Vmic)。
1.4 降解实验向锥形瓶中加入100 mL 20 mg·L-1的橙黄G溶液。然后, 依次加入过硫酸钠和生物炭, 密封后置于恒温振荡器中以110 r·min-1转速(离心半径为12 mm)在25 ℃条件下振荡。在设定时间取样, 样品经0.45 μm孔径滤膜过滤后采用UV752N型紫外-可见分光光度计(上海佑科仪器仪表有限公司)在478 nm波长条件下测定, 计算剩余橙黄G浓度。过硫酸钠和生物炭投加量的默认值为5 mmol·L-1和0.3 g·L-1。pH实验中, 采用0.1 mol·L-1硫酸或氢氧化钠溶液将橙黄G溶液的初始pH值调整至设定值。
橙黄G溶液初始浓度记为C0(mg·L-1), 剩余浓度记为C(mg·L-1), 以C/C0表示染料的去除效果。
2 结果与分析 2.1 蓝藻生物炭的表征成功等[13]研究发现, 水华蓝藻的热解过程可以分为原料水分的蒸发过程(<170 ℃)、蛋白质和多糖类有机大分子的热解(170~530 ℃)和残留固定碳的缓慢分解(>530 ℃)3个阶段。蓝藻生物炭的得率及元素分析见表 1。
|
|
表 1 蓝藻生物炭的得率及元素分析 Table 1 Yields and element compositions of cyanobacteria-based biochars |
表 1显示, 在300~500 ℃范围内, 随着热解温度的升高, 生物质逐渐烧失汽化, 生物炭得率下降, 相同温度条件下磷酸预处理制得的生物炭(CHB)得率明显高于氢氧化钠预处理制得的生物炭(CNB)。在生物炭制备过程中发现, 氢氧化钠预处理过的蓝藻会散发浓重的气味, 这可能是由于蓝藻中的藻蛋白在强碱作用下发生分解, 热解过程中的高温进一步加剧了这一反应, 从而使得CNB得率低于CHB。元素分析结果显示, 蓝藻生物炭中以碳元素为主, CHB中碳含量比CNB高, 随着热解温度的升高, C、N、S、H 4种元素质量含量呈现下降趋势, 因此推测, 其他元素(主要是氧)质量含量会随着温度的升高而增加。
蓝藻生物炭的比表面积和孔径分析结果见表 2。6种生物炭中主要是中孔和大孔, 仅CNB500中存在少量微孔, CNB平均孔径大于CHB。随着热解温度的升高, 生物质烧失加剧, 生物炭比表面积和孔容增加, 相同温度下CNB比表面积和孔容明显高于CHB, CNB500比表面积超过100 m2·g-1, 这说明与磷酸预处理相比, 采用氢氧化钠预处理更利于孔的形成和扩展。有研究表明, 与磷酸、氯化锌等化学试剂相比, 强碱(氢氧化钠、氢氧化钾等)对生物质具有更强烈的刻蚀作用, 因此常作为活化剂用于高比表面积活性炭的制备[14]。
|
|
表 2 蓝藻生物炭的比表面积与孔容 Table 2 Specific surface areas and pore volumes of cyanobacteria-based biochars |
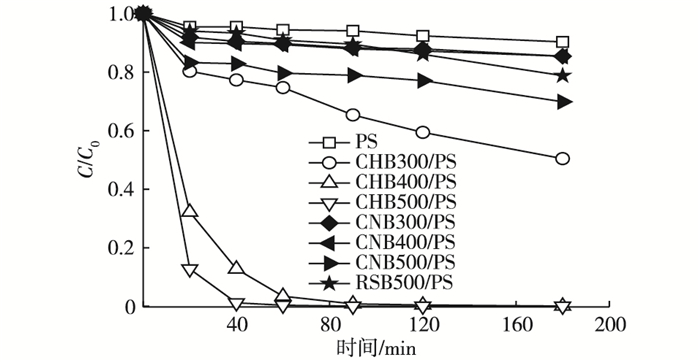
以蓝藻生物炭作为过硫酸盐活化剂, 以橙黄G作为目标污染物, 通过橙黄G的降解去除率来评价生物炭的活化效果, 结果见图 1。
|
图 1 蓝藻生物炭/过硫酸盐体系对橙黄G的去除效果 Figure 1 Orange G removal of the cyanobacteria-based biochar / PS system PS为过硫酸钠, RSB500为热解温度为500 ℃条件下制得的水稻秸秆生物炭。其他物质名称说明见表 1。C0和C分别为橙黄G溶液初始浓度和剩余浓度。 |
单独过硫酸盐(PS)对橙黄G的去除作用很弱, 180 min时的去除率仅为10%。生物炭的添加可以提高体系对橙黄G的去除效果。其中, 相同温度下制备的CHB的作用明显优于CNB, 这说明预处理方式对生物炭的性能具有显著影响。随着热解温度的升高, 生物炭的作用增强, CHB500/PS体系对染料的去除作用最好, 40 min时的去除率即可达到99.9%。水稻秸秆生物炭RSB500/PS体系对染料的去除作用较弱, 180 min的去除率仅为21.2%。蓝藻生物炭CHB具有显著优势。
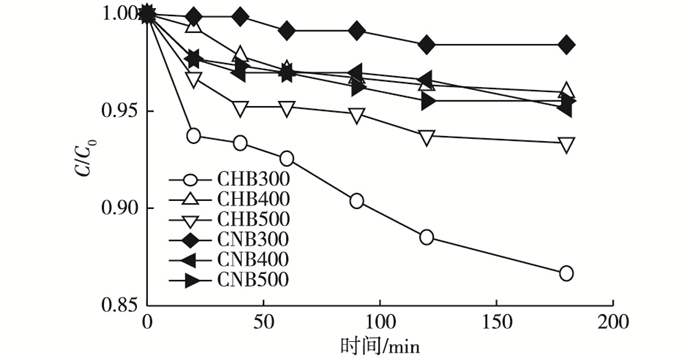
由于单独过硫酸盐对橙黄G的去除作用有限(图 1), 蓝藻生物炭/过硫酸盐体系对橙黄G的去除可以通过以下2种途径实现:生物炭的吸附作用和生物炭活化过硫酸盐的氧化降解作用。因此, 对蓝藻生物炭吸附橙黄G的去除作用进行研究, 结果见图 2。
|
图 2 蓝藻生物炭对橙黄G的吸附去除效果 Figure 2 Orange G removal and adsorption of cyanobacteria-based biochars 物质名称说明见表 1。C0和C分别为橙黄G溶液初始浓度和剩余浓度。 |
蓝藻生物炭对橙黄G的吸附去除作用较弱, 效果最好的CHB300在180 min的去除率也仅为13.4%, 其他5种生物炭的效果相近, 180 min时的去除率为1.6%~6.3%。因此, 蓝藻生物炭/过硫酸盐体系(特别是CHB/PS)对橙黄G的去除主要是通过生物炭活化过硫酸盐的氧化降解作用实现的。6种生物炭中, 采用磷酸活化法在500 ℃条件下制备的生物炭(CHB500)具有非常好的过硫酸盐活化性能(图 1), 因此将其作为活化剂用于后续实验研究。
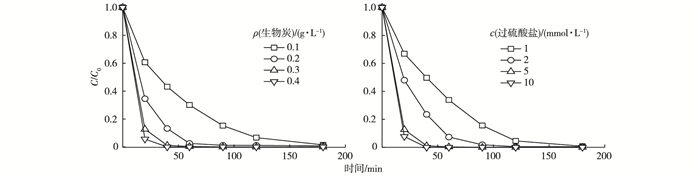
2.3 生物炭和过硫酸盐投加量的影响CHB500投加量对生物炭/过硫酸盐体系去除橙黄G的影响见图 3。随着投加量的增加, 反应活性位点增多, 体系对橙黄G的降解速率增大。采用一级动力学方程对数据进行拟合分析(R2>0.97), 4种投加量条件下的去除速率常数分别为0.023 0、0.051 3、0.086 4和0.195 4 min-1。即使在0.1 g·L-1的低投加量条件下, 180 min时染料的去除率也可达98.5%, 这说明单位质量的CHB500具有非常多的反应活性位点, 因此显示出非常好的过硫酸盐活化性能。
|
图 3 生物炭和过硫酸盐投加量对橙黄G去除效果的影响 Figure 3 Effects of dosages of biochar and persulfate on removal of Orange G C0和C分别为橙黄G溶液初始浓度和剩余浓度。 |
过硫酸盐投加量对体系降解橙黄G的影响见图 3。过硫酸盐投加量的增加提高了体系对染料的去除效率。采用一级动力学方程对数据进行拟合分析(R2>0.96), 4种投加量条件下的去除速率常数分别为0.026 9、0.044 9、0.086 4和0.195 4 min-1。由于CHB500含有很多反应位点, 适当增加过硫酸盐, 可以提高这些位点的利用率, 从而促进体系对染料的降解。
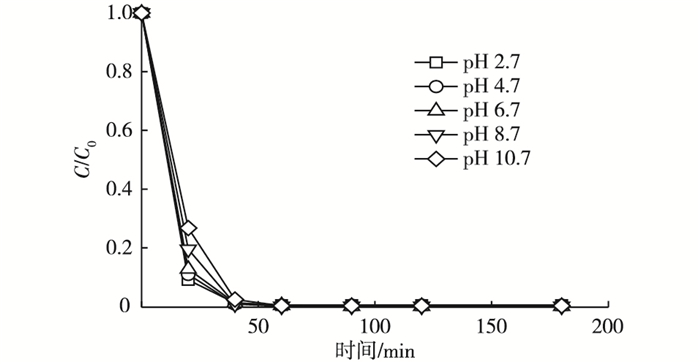
2.4 pH的影响在高级氧化技术中, pH往往是影响污染物去除效率的重要因素。pH对橙黄G去除效果的影响见图 4。
|
图 4 pH对橙黄G去除效果的影响 Figure 4 Effect of pH on removal of Orange G C0和C分别为橙黄G溶液初始浓度和剩余浓度。 |
图 4显示, 随着溶液初始pH值的增加, 橙黄G的去除率略有降低, 酸性条件更利于橙黄G的去除。这可能是因为随着pH值的升高, 硫酸根自由基与氢氧根发生反应, 生成了氧化能力比较弱的羟基自由基, 碱性越强, 消耗的硫酸根自由基越多, 从而使得降解率降低[15]。虽然pH值升高导致橙黄G去除效率降低, 但是影响不大, 在pH值为2.7~10.7条件下, 40 min时的去除率均能达到97%以上。与芬顿等高级氧化技术相比, 蓝藻生物炭/过硫酸盐体系可以在较宽pH范围内的废水中使用。
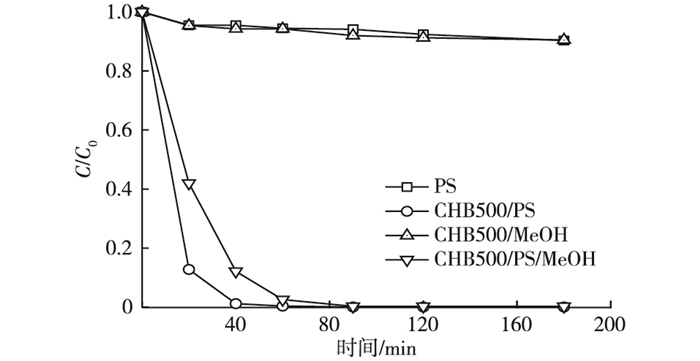
2.5 机理分析研究表明, 过硫酸盐活化可以通过自由基(如Fe2+活化[16])和非自由基(如碳纳米管活化[17])2种机制实现。甲醇是一种常见的自由基抑制剂, 它极易与羟基自由基和硫酸根自由基发生反应, 从而抑制此类机制的反应过程[18]。为探究自由基和非自由基机制在体系中发挥的作用, 笔者向系统中加入高比例的甲醇(甲醇与过硫酸盐摩尔比为2 400:1)。如图 5所示, 橙黄G的去除速率常数由0.086 4 min-1降低到0.067 0 min-1(一级动力学方程拟合, R2>0.96), 可见, 自由基机制在体系中发挥了一定作用。值得注意的是, 加入高比例甲醇后的CHB500/PS/MeOH体系仍然具有很高的降解速率, 90 min内的去除率即可达到99.7%。由于自由基反应已被甲醇抑制, 且CHB500对染料的吸附作用很弱(图 5), 因此, 染料的去除是通过非自由基机制的降解实现的。因此, 蓝藻生物炭/过硫酸盐体系对橙黄G的降解是通过自由基和非自由基2种机制的共同作用实现的, 其中, 非自由基机制作用显著。
|
图 5 自由基抑制剂对橙黄G去除效果的影响 Figure 5 Effect of radical inhibitor on removal of Orange G PS为过硫酸钠, CHB500为经磷酸预处理的热解温度为500 ℃条件下制得的生物炭, MeOH为甲醇。C0和C分别为橙黄G溶液的初始浓度和剩余浓度。 |
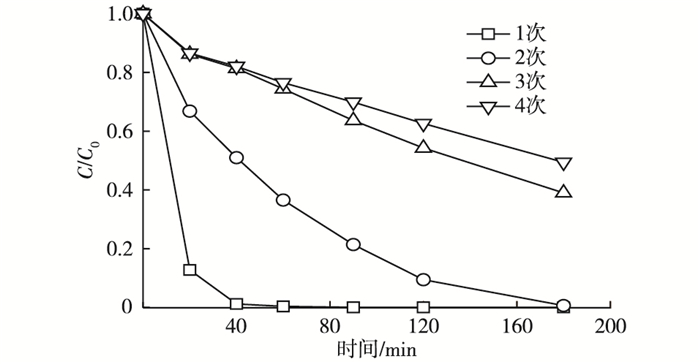
采用循环实验对生物炭的重复利用性能进行评价。生物炭多次使用对橙黄G的去除效果见图 6。
|
图 6 生物炭多次使用对橙黄G的去除效果 Figure 6 Effect of repeated use of biochars on removal of Orange G C0和C分别为橙黄G溶液初始浓度和剩余浓度。 |
如图 6所示, 随着使用次数的增加, 蓝藻生物炭/过硫酸盐体系对橙黄G的去除效率常数逐渐降低, 第2、3、4次使用时的去除速率分别为0.026 7、0.005 1和0.003 7 min-1(一级动力学方程拟合, R2>0.93), 180 min时的去除率分别为99.4%、61.0%和50.6%。去除速率的降低可能是由于每次使用导致生物炭表面被部分氧化, 还原性降低, 影响了其表面的电子传递性能。但是, 从第3次和第4次降解曲线的趋势可以看出, 适当延长反应时间仍然可以达到满意的去除效果。
3 结论(1) 预处理方式和热解温度影响蓝藻生物炭的物理化学性质。与磷酸预处理相比, 氢氧化钠预处理得到的生物炭得率和碳元素含量较低, 但孔径结构较为发达; 提高热解温度会导致生物炭的得率和碳含量降低, 但利于其孔道的形成和扩展。
(2) 预处理方式和热解温度会对蓝藻生物炭活化过硫酸盐的性能产生显著影响。与氢氧化钠预处理相比, 磷酸预处理得到的生物炭优势明显; 升高热解温度可以提高生物炭的活化性能。
(3) CHB500(磷酸预处理, 500 ℃条件下热解制备的蓝藻生物炭)具有非常好的过硫酸盐活化性能。CHB500/PS体系可以在自由基和非自由基机制的共同作用下实现橙黄G的高效降解。增加生物炭和过硫酸钠投加量可以提高染料的去除效率, pH对染料去除率的影响较小。随着生物炭使用次数的增加, 体系的效率降低, 适当延长反应时间可以进一步实现染料的去除。
| [1] |
LIU Y Q, HE X X, FU Y S, et al. Kinetics and Mechanism Investigation on the Destruction of Oxytetracycline by UV-254 nm Activation of Persulfate[J]. Journal of Hazardous Materials, 2016, 305: 229-239. DOI:10.1016/j.jhazmat.2015.11.043 (  0) 0) |
| [2] |
NIE M H, YANG Y, ZHANG Z J, et al. Degradation of Chloramphenicol by Thermally Activated Persulfate in Aqueous Solution[J]. Chemical Engineering Journal, 2014, 246: 373-382. DOI:10.1016/j.cej.2014.02.047 (  0) 0) |
| [3] |
EPOLD I, TRAPIDO M, DULOVA N. Degradation of Levofloxacin in Aqueous Solutions by Fenton, Ferrous Ion-Activated Persulfate and Combined Fenton/Persulfate Systems[J]. Chemical Engineering Journal, 2015, 279: 452-462. DOI:10.1016/j.cej.2015.05.054 (  0) 0) |
| [4] |
房彬, 李心清, 赵斌, 等. 生物炭对旱作农田土壤理化性质及作物产量的影响[J]. 生态环境学报, 2014, 23(8): 1292-1297. FANG Bin, LI Xin-qing, ZHAO Bin, et al. Influence of Biochar on Soil Physical and Chemical Properties and Crop Yields in Rainfed Field[J]. Ecology and Environmental Sciences, 2014, 23(8): 1292-1297. (  0) 0) |
| [5] |
贾俊香, 熊正琴. 秸秆生物炭对菜地N2O、CO2与CH4排放及土壤化学性质的影响[J]. 生态与农村环境学报, 2016, 32(2): 283-288. JIA Jun-xiang, XIONG Zheng-qin. Impact of Application of Maize Stalk-Derived Biochar on Soil Properties and N2O, CO2 and CH4 Emissions From Vegetable Fields[J]. Journal of Ecology and Rural Environment, 2016, 32(2): 283-288. DOI:10.11934/j.issn.1673-4831.2016.02.017 (  0) 0) |
| [6] |
UCHIMIYA M, WARTELLE L H, KLASSON K T, et al. Influence of Pyrolysis Temperature on Biochar Property and Function as a Heavy Metal Sorbent in Soil[J]. Journal of Agricultural and Food Chemistry, 2011, 59(6): 2501-2510. DOI:10.1021/jf104206c (  0) 0) |
| [7] |
毛懿德, 铁柏清, 叶长城, 等. 生物炭对重污染土壤镉形态及油菜吸收镉的影响[J]. 生态与农村环境学报, 2015, 31(4): 579-582. MAO Yi-de, TIE Bo-qing, YE Chang-cheng, et al. Effects of Biochar on Forms and Uptake of Cadmium by Rapeseed in Cadmium-Polluted Soil[J]. Journal of Ecology and Rural Environment, 2015, 31(4): 579-582. DOI:10.11934/j.issn.1673-4831.2015.04.021 (  0) 0) |
| [8] |
孔露露, 周启星. 新制备生物炭的特性表征及其对石油烃污染土壤的吸附效果[J]. 环境工程学报, 2015, 9(5): 2462-2468. KONG Lu-lu, ZHOU Qi-xing. Characterizaiton of New-Prepared Biochars and Their Adsorption Effectiveness on Petroleum Hydrocarbon Contaminated Soil[J]. Chinese Journal of Environmental Engineering, 2015, 9(5): 2462-2468. DOI:10.12030/j.cjee.20150570 (  0) 0) |
| [9] |
ZHANG X, WANG H, HE L, et al. Using Biochar for Remediation of Soils Contaminated With Heavy Metals and Organic Pollutants[J]. Environmental Science and Pollution Research, 2013, 20(12): 8472-8483. DOI:10.1007/s11356-013-1659-0 (  0) 0) |
| [10] |
FANG G, LIU C, GAO J, et al. Manipulation of Persistent Free Radicals in Biochar to Activate Persulfate for Contaminant Degradation[J]. Environmental Science & Technology, 2015, 49(9): 5645-5653. (  0) 0) |
| [11] |
闫冉, 李云利, 毕相东, 等. 有害蓝藻资源化利用现状和发展趋势[J]. 天津农业科学, 2015, 21(5): 72-76. YAN Ran, LI Yun-li, BI Xiang-dong, et al. Resource Utilization of Harmful Cyanobacteria and Its Development Tendency[J]. Tianjin Agricultural Sciences, 2015, 21(5): 72-76. (  0) 0) |
| [12] |
刘向东, 董雪, 隋欢, 等. 农作物废弃物制备生物炭的实验研究[J]. 佳木斯大学学报(自然科学版), 2016, 34(3): 330-332. LIU Xiang-dong, DONG Xue, SUI Huan, et al. Experimental Study on the Preparation of Biochar From Crop Waste[J]. Journal of Jiamusi University(Natural Science Edition), 2016, 34(3): 330-332. (  0) 0) |
| [13] |
成功, 郑洋, 莫凤鸾, 等. 水华蓝藻热解特性及热解动力学研究[J]. 可再生能源, 2014, 32(6): 881-885. CHENG Gong, ZHENG Yang, MO Feng-luan, et al. Characteristics and Kinetic Studies on Pyrolysis of Blooming-Forming Cyanobacteria[J]. Renewable Energy Resources, 2014, 32(6): 881-885. (  0) 0) |
| [14] |
蒋剑春, 孙康. 活性炭制备技术及应用研究综述[J]. 林产化学与工业, 2017, 37(1): 1-13. JIANG Jian-chun, SUN Kang. Review on Preparation Technology of Activated Carbon and Its Application[J]. Chemistry and Industry of Forest Products, 2017, 37(1): 1-13. (  0) 0) |
| [15] |
王晨曦, 万金泉, 马邕文, 等. 负载型颗粒活性炭催化过硫酸钠氧化降解橙黄G[J]. 环境工程学报, 2015, 9(1): 213-218. WANG Chen-xi, WAN Jin-quan, MA Yong-wen, et al. Degradation of Orange G Catalyzed by Fe/GAC in the Presence of Persulfate[J]. Chinese Journal of Environmental Engineering, 2015, 9(1): 213-218. DOI:10.12030/j.cjee.20150135 (  0) 0) |
| [16] |
XU X R, LI X Z. Degradation of Azo Dye Orange G in Aqueous Solutions by Persulfate With Ferrous Ion[J]. Separation and Purification Technology, 2010, 72(1): 105-111. DOI:10.1016/j.seppur.2010.01.012 (  0) 0) |
| [17] |
LEE H S, LEE H J, JEONG J, et al. Activation of Persulfates by Carbon Nanotubes:Oxidation of Organic Compounds by Nonradical Mechanism[J]. Chemical Engineering Journal, 2015, 266: 28-33. DOI:10.1016/j.cej.2014.12.065 (  0) 0) |
| [18] |
ANIPSITAKIS G P, DIONYSIOU D D. Degradation of Organic Contaminants in Water With Sulfate Radicals Generated by the Conjunction of Peroxymonosulfate With Cobalt[J]. Environmental Science & Technology, 2003, 37(20): 4790-4797. (  0) 0) |




