2. 江苏省环境保护水环境生物监测重点实验室/常州市环境监测中心, 江苏 常州 213001;
3. 长沙理工大学水利工程学院, 湖南 长沙 410114;
4. 南京大学环境学院污染控制与资源化研究国家重点实验室, 江苏 南京 210023
2. Key Laboratory of Environmental Protection of Water Environment Biological Monitoring of Jiangsu Province/Changzhou Environmental Monitoring Center, Changzhou 213001, China;
3. School of Hydraulic Engineering, Changsha University of Science and Technology, Changsha 410114, China;
4. State Key Laboratory of Pollution Control and Resources Reuse, School of Environment, Nanjing University, Nanjing 210023, China
竺山湾是太湖西北部半封闭浅水湖湾, 平均水深为2.0 m, 水面面积为57.2 km2[1], 涉及常州市武进区和无锡市马山区、宜兴市。由于大多数入湖河流主要位于太湖流域西部和西北部[2], 导致竺山湾富营养化较严重。近年来, 政府部门大力开展蓝藻打捞、疏浚清淤、调水引流、水产及畜禽养殖取缔迁移和建设污水处理管网等措施, 连续十年实现2个“确保”。但是根据长期监测结果发现, 与其他湖区相比竺山湾湖区水质较差, 蓝藻水华仍频繁发生。不少学者已经研究了竺山湾蓝藻暴发机理[3]、蓝藻水华预警[4]、浮游植物分布、营养元素的转化和重金属分布及生态风险评估[5-7], 也分别对浮游细菌和沉积物细菌进行研究[8-9], 但是对竺山湾浮游细菌和沉积物细菌同时开展研究的报道还较少。
已有研究者采用DGGE[10-11]、T-RFLP[12]和荧光定量PCR[13-14]等技术分析微生物群落结构。近年来, 由于拥有高分辨率且可以同时分析上百个样品, 高通量测序技术在生物群落结构分析方面显示出巨大优势, 是研究细菌群落组成和丰度的重要工具[15], 成为研究蓝藻水华与微生物之间相互关系的新方法。一些学者利用高通量测序技术对高原淡水湖泊[16]、长江[17]和全太湖[18]细菌群落结构进行研究, 也有一些关于竺山湾的研究, 如FAN等[19]采用Illumina测序技术研究发现竺山湾沉积物中古菌与湖泛有关, 但利用高通量测序技术研究竺山湾细菌群落结构的研究还鲜有报道。以往对于蓝藻水华的防控主要集中在春夏两季, 但受到全球气候变化等的影响, 蓝藻水华暴发时间在逐渐提前。因此, 笔者基于16S rRNA基因高通量测序技术与多种统计分析方法, 观测太湖竺山湾在冬季(11月)蓝藻暴发后浮游细菌和沉积物细菌群落的多样性, 并将优势浮游细菌属与典型环境因子进行冗余分析(redundancy analysis, RDA), 为探究富营养化水体中细菌群落结构组成和对太湖蓝藻水华进行早期预警提供依据。
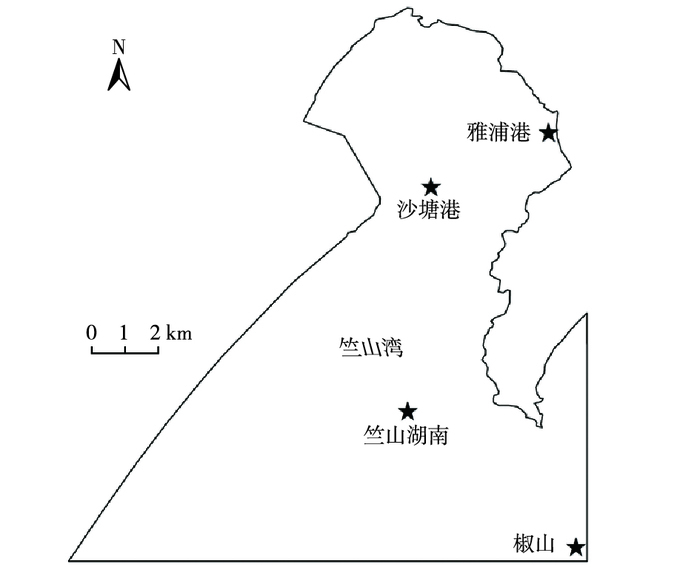
1 材料与方法 1.1 样品采集与DNA提取 1.1.1 样品采集于2015年11月在竺山湾水体的4个采样点采集表层湖水和沉积物样品(图 1), 从北向南依次为雅浦港(YPG; 31.449° N, 120.075° E)、沙塘港(STG; 31.433° N, 120.035° E)、竺山湖南(ZSHN; 31.373° N, 120.036° E)和椒山(JS; 31.340° N,120.076° E), 其中,雅浦港和沙塘港属河口区(HK), 竺山湖南和椒山属湖心区(HX)。分别使用直立式水质采样器和彼得森采样器采集水样和沉积物样品。
|
图 1 竺山湾水体采样点示意 Figure 1 Sampling sites in the Zhushan Bay |
所有样品采集后均保存在冷藏箱中, 送达实验室后立即进行预处理。将水样通过0.22 μm孔径的混合纤维素滤膜进行过滤, 待滤膜完全堵住后, 记录过滤的水样体积。沉积物样品则放置于50 mL离心管中, 以10 000 r·min-1转速进行离心(离心半径为12.3 cm), 将分离得到的滤膜和固态沉积物浸没于φ=50%的乙醇溶液中, 并保存在-20 ℃条件下, 用于后续的分析测试。
1.1.3 样品中DNA的提取按照FastDNA Spin Kit for Soil试剂盒(MP bio, 美国)说明书的步骤提取水样和沉积物样品中微生物DNA。使用NanoDrop 2000超微量核酸蛋白分析仪(Thermo Fisher, 美国)对提取的DNA浓度和纯度进行测定, 并在-20 ℃条件下保存测定后的DNA样品, 用于后续的PCR扩增等分析。
1.2 16S rRNA基因高通量测序 1.2.1 PCR扩增和纯化将提取的DNA样品稀释至20 ng·μL-1, 每个样品设4个平行。选用V1~V2保守区的引物对提取的DNA样品进行PCR扩增, 引物序列(5′—3′)如下:正向引27F(AGAGTTTGATYMTGGCTCAG), 反向引物338R(TGCTGCCTCCCGTAGGAGT)。PCR扩增体系包含0.25 μL的Ex Taq DNA, 5 μL的10×Ex Taq Buffer, 4 μL的25 mmol·L-1MgCl2, 4 μL的dNTP, 正向引物和反向引物各1 μL, 2 μL的DNA模板和32.75 μL超纯水。PCR扩增过程如下:98 ℃预变性5 min; 98 ℃变性30 s, 退火温度50 ℃条件下反应30 s, 72 ℃延伸40 s, 共20个循环; 最后72 ℃条件下延伸10 min。PCR扩增产物用10 g·L-1琼脂糖电泳仪进行检测。将4个平行样品的PCR扩增产物混合, 用E.Z.N.A.TM Cylcle-Pure试剂盒(Omega Bio-tec Inc, 美国)进行纯化。纯化后的产物用NanoDrop 2000超微量核酸蛋白分析仪测定浓度和纯度。
1.2.2 高通量测序数据分析采用Illumina Miseq平台(2.5.0.5版, USA)进行高通量测序(由江苏中宜金大分析检测有限公司提供)。测序结果采用Sickle(1.33版)和Mothur(1.35.1版)程序进行降噪处理后, 以条序列最少的样品为基准, 采用Mothur软件(1.32.1版)的“Sub.sample”命令从其他样品中随机抽取相同的条序列, 统一测序深度。每个样品在相同测序深度下采用Ribosomal Database Project Classifier(2.6版)处理平台进行系统分类和注释。处理后的数据采用Origin(9.0版)绘图, 采用R语言(3.1.0版)绘制热图和稀释曲线并进行主坐标分析(principal coordinate analysis, PCoA)。采用Qiime软件(1.7.0版)计算丰富度指数(Chao1和ACE指数)、覆盖度指数(Coverage指数)和多样性指数(Shannon指数)[20]。采用CANOCO(4.5版)软件对浮游细菌属和环境因子进行冗余分析[21]。
2 结果与讨论 2.1 理化指标分析竺山湾冬季4个采样点水质理化指标见表 1。根据《地表水环境质量评价办法(试行)》[22], 选择总磷、总氮和叶绿素a进行湖泊营养状态评价, 2个河口区营养化水平为中度, 2个湖心区为轻度。4个采样点水样均偏碱性, 这是由于藻类大量繁殖造成的[23]。椒山藻密度最大, 为48 798 mL-1, 远高于其余采样点, 可能是由于竺山湾冬季的主导风向为西北风, 而椒山位于下风处, 导致藻类在椒山集聚。
|
|
表 1 竺山湾水体理化指标分析 Table 1 Physico-chemical properties of the water in the Zhushan Bay |
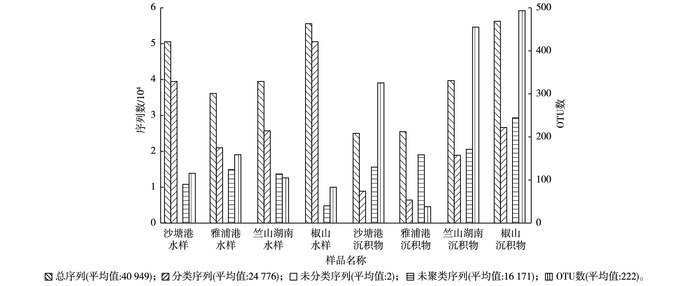
各个样品的微生物序列统计结果见图 2。对竺山湾水样及沉积物样品中获得的数据进行处理, 得到有效序列总计327 591条, 分类序列总计198 207条, 其中水样中有效序列数和分类序列数分别为181 433和136 725条, 分别高于沉积物中有效序列数(146 158条)和分类序列数(61 482条)。
|
图 2 各样品的OTU聚类和注释 Figure 2 OTUs clustering and annotation of each sample |
为了研究样品的物种组成多样性, 对所有样品的有效序列进行聚类, 以97%的一致性(identity)将序列聚类成操作分类单元(operational taxonomic unit, OTU)[24], 其中湖心区2个水样中OTU数均低于河口区, 与水质富营养化指数的比较结果相一致。但湖心区2个沉积物样品中OTU数与河口区相比却较高。
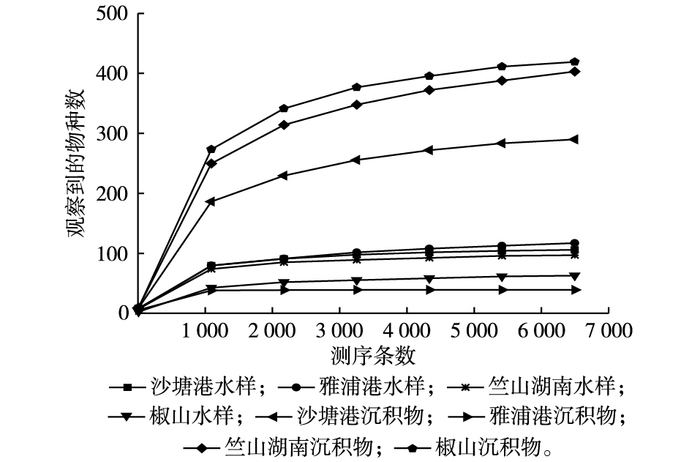
对样品进行随机抽样, 以抽取的测序数据量与对应的物种数构建稀释曲线(图 3)。当随机抽取的测序条数大于2 000时, 8个样品中的物种数趋于稳定, 说明测序量合理, 能够代表大多数的物种。
|
图 3 水样和沉积物样品的稀释曲线 Figure 3 Rarefaction curve of water and sediment samples |
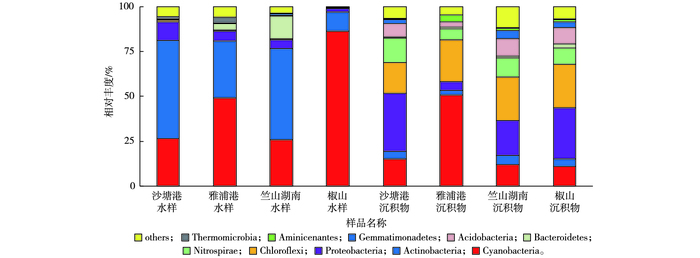
由图 4可知, 水样中平均相对丰度(46.95%)最高的细菌为蓝藻细菌门(Cyanobacteria), 相对丰度较高的有放线菌门(Actinobacteria, 37.02%)、变形菌门(Proteobacteria, 5.67%)和拟杆菌门(Bacteroidetes, 4.09%), 上述细菌在丹江口水库[25]、赛里木湖[26]和滆湖[27]均有发现。其中, 椒山水样中蓝藻细菌门相对丰度(86.32%)最高, 是其他采样点的1.8~3.3倍。SU等[8]发现在冬季蓝藻细菌在水中的占比最低, 而蓝藻细菌通常为夏季太湖的优势细菌[28]。与夏季太湖竺山湾水体细菌群落的研究结果[29]相比, 笔者研究中蓝藻细菌在冬季已成为水样中的优势细菌, 或许能为蓝藻暴发时间的提前提供预警和指示。
|
图 4 水样和沉积物样门水平优势细菌分布 Figure 4 Distribution of dominant bacteria in the water and sediment samples at the phylum level |
与水样相比, 沉积物中细菌多样性较为丰富, 除相对丰度较高的绿弯菌门(Chloroflexi, 22.20%)、蓝藻细菌门(22.19%)和变形菌门(21.32%)外, 其他相对丰度较高的细菌有硝化螺旋菌门(Nitrospirae, 9.89%)、酸杆菌门(Acidobacteria, 7.26%)、放线菌门(4.10%)和芽单胞菌门(Gemmatimonadetes, 2.60%), YE等[30]对冬季太湖沉积物细菌群落研究也发现上述细菌。已有研究表明变形菌门是太湖沉积物的优势细菌[31], 可以参与环境中有机物的生物降解。相对丰度最高的绿弯菌门在沉积物中的作用尚未被完全认知, 相关研究认为其功能与碳循环相关[32]。SHAO等[33]对太湖藻型区夏季和冬季沉积物研究均发现蓝藻, 但其并非优势细菌。而笔者研究中4个沉积物样品中蓝藻细菌相对丰度为10.77%~50.74%, 为第2大优势细菌门, 可见, 蓝藻细菌在冬季竺山湾沉积物中的相对丰度逐渐增大。
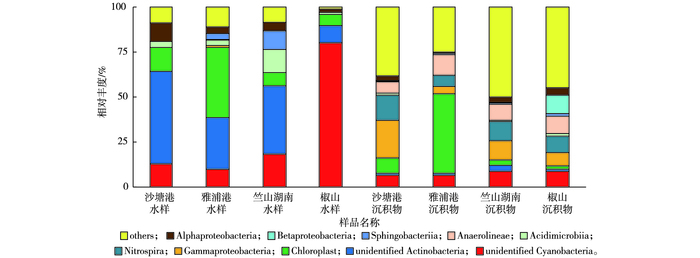
2.3.2 纲水平细菌对相对丰度居前10位的细菌进行纲水平的分类。由图 5可知, 水样中平均相对丰度(31.87%)最高的细菌为未分类的放线菌纲(unidentified Actinobacteria), 相对丰度较高的主要有未分类的蓝藻细菌纲(unidentified Cyanobacteria,30.46%)、Chloroplast(16.48%)、α-变形菌纲(Alphaproteobacteria, 5.20%)、酸微菌纲(Acidimicrobiia, 5.16%)和鞘脂杆菌纲(Sphingobacteriia, 3.35%)。相对丰度最高的未分类的放线菌纲在4个采样点中的排序为沙塘港(51.35%)>竺山湖南(37.83%)>雅浦港(28.67%)>椒山(9.62%)。值得关注的是, 1种未分类的蓝藻细菌纲在水样中的相对丰度较高, 其在椒山水样中相对丰度最高, 为80.15%, 远高于其他采样点(10.13%~18.54%)。
|
图 5 水样和沉积物样纲水平优势细菌分布 Figure 5 Distribution of dominant bacteria in the water and sediment samples at the class level |
沉积物中平均相对丰度最高的细菌为Chloroplast(14.34%), 其次主要有γ-变形菌纲(Gammaproteobacteria, 10.97%)、硝化螺旋菌纲(Nitrospira, 9.89%)和厌氧绳菌纲(Anaerolineae, 9.18%)。相对丰度居第1位的Chloroplast为蓝藻细菌门下的纲, 在雅浦港中相对丰度最高(44.15%), 在其余采样点的相对丰度为1.75%~8.49%。γ-变形菌纲是严重富营养化时太湖所具有的特征性种群[34], 它的出现应引起重视。
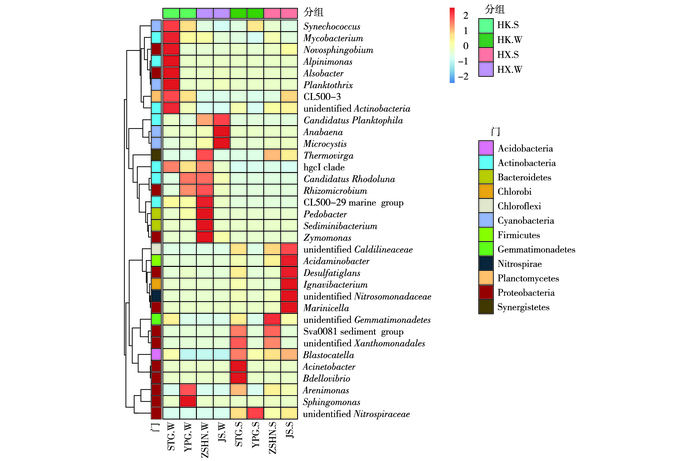
2.3.3 属水平细菌根据所有样品在属水平的物种注释及丰度信息, 选取相对丰度排名居前34位的属, 根据其在每个样品中的相对丰度信息, 从物种和样品2个层面进行聚类, 绘制成热图(图 6)。水样中的优势细菌有微囊藻属(Microcystis)(椒山水样中相对丰度最高, 为75.52%, 沙塘港水样最低, 为0.28%, 其余水样为5.65%~15.31%)和hgcI clade(沙塘港水样中相对丰度与竺山湖南水样相近, 分别为32.93%和32.06%, 其余采样点相对丰度为6.8%~20.7%)。微囊藻属是导致夏季太湖水华暴发的主要物种[35], 笔者研究中微囊藻属在冬季已成为优势细菌, 这为蓝藻暴发时间的提前提供一定依据。hgcI clade属于放线菌目下的属, SUN等[36]发现河口水库中同样存在hgcI clade, 且为水库中的优势细菌, hgcI clade有很强的摄取碳水化合物和富氮有机化合物的遗传能力[37], 推测它参与水中碳循环和氮循环。
|
图 6 水样和沉积物样属水平优势细菌分布 Figure 6 Distribution of dominant bacteria in the water and sediment samples at the genus level STG.W为沙塘港水样, YPG.W为雅浦港水样, ZSHN.W为竺山湖南水样, JS.W为椒山水样, STG.S为沙塘港沉积物, YPG.S为雅浦港沉积物, ZSHN.S为竺山湖南沉积物, JS.S为椒山沉积物。图例中数字表示各个物种相对丰度经过标准化处理后得到的Z值,即为样品在该分类上的相对丰度和所有样品在该分类的平均相对丰度的差除以所有样品在该分类上的标准差所得到的值,Z值越大表示物种相对丰度越大,反之越小。 |
沉积物中的优势细菌有微囊藻属(椒山和竺山湖南样点中相对丰度较高, 分别为7.56%和7.11%, 沙塘港与雅浦港样点相对丰度分别为3.74%和2.68%)和未分类的硝化螺旋菌属(un-identified Nitrospiraceae,雅浦港沉积物样中相对丰度最高, 为3.34%, 竺山湖南最低, 为0.89%, 其余样点为1.45%~1.75%)。与水样相比, 沉积物的优势细菌中含有与硝化作用相关的未分类的硝化螺旋菌属。
2.4 样品复杂度分析 2.4.1 α多样性分析由表 2可知, 8组样品的覆盖度指数除竺山湖南沉积物样(98.7%)外, 其余均在99.0%以上, 表明该次测序可以反映样本的真实情况。通过Chao1、ACE和Shannon指数对各个样品的细菌丰度和多样性进行评估, 发现沉积物中细菌平均丰富度指数和多样性指数均大于水样, 说明沉积物中细菌丰度和多样性均较高, 与聚类分析结果一致。寇文伯等[38]通过对鄱阳湖细菌群落分析也发现沉积物中细菌丰度和多样性均大于表层水体。综合Chao1指数、ACE指数和Shannon指数, 各样点水样中细菌多样性大小依次为沙塘港、雅浦港、竺山湖南和椒山, 河口区水样中细菌多样性大于湖心区, 这与河口区水样富营养化指数大于湖心区的结果相一致, 表明水体细菌多样性与水体水质有关。各样点沉积物中细菌多样性大小依次为竺山湖南、椒山、雅浦港和沙塘港, 湖心区沉积物中细菌多样性大于河口区。这可能是因为河口区受入湖河流水动力的作用使沉积物再悬浮的同时, 向水体释放大量营养物质, 导致沉积物中细菌多样性降低, 水体中浮游细菌多样性增加; 而湖心区受入湖河流影响小, 沉积物中细菌多样性要大于河口区。
|
|
表 2 细菌群落的多样性指数 Table 2 Diversity index of the bacterial community |
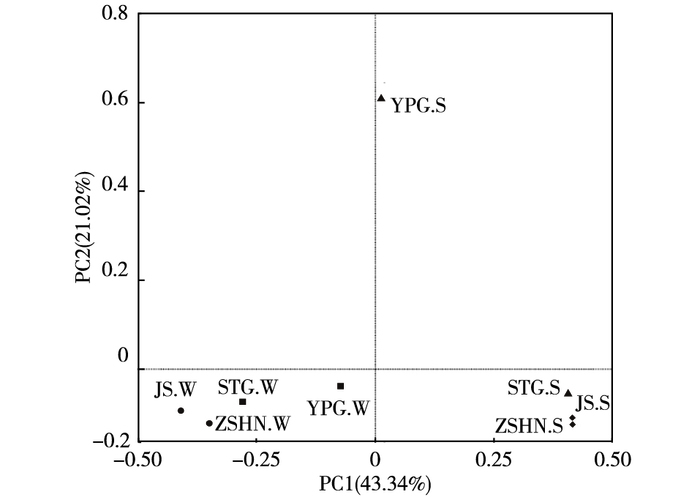
采用PCoA分析研究样品间的差异性。笔者研究中PC1贡献值为43.34%, PC2贡献值为21.02%, 贡献值总计为64.36%, 可以用来解释变量信息。各采样点样品主坐标分析结果见图 7。
|
图 7 各采样点样品主坐标分析 Figure 7 PCoA analysis of the samples collected from each sampling site STG.W为沙塘港水样;YPG.W为雅浦港水样;ZSHN.W为竺山湖南水样;JS.W为椒山水样;STG.S为沙塘港沉积物;YPG.S为雅浦港沉积物;ZSHN.S为竺山湖南沉积物;JS.S为椒山沉积物。▲河口沉积物样;■河口水样;◆湖心沉积物样;●湖心水样。 |
如图 7所示, 水样与沉积物样品中除雅浦港外, 其余水样和沉积物样品中的各自采样点之间距离均较近, 这可能是因为雅浦港在4个采样点中富营养化水平最高, 直接导致细菌多样性增加, 从而分别与其他采样点水样和沉积物样品中细菌多样性产生差异。从总体上看, 水样和沉积物样品之间距离较远, 说明两者细菌组成结构差异较大, 可能是由于湖面受风浪扰动较大, 而湖底受风浪影响较小所致。
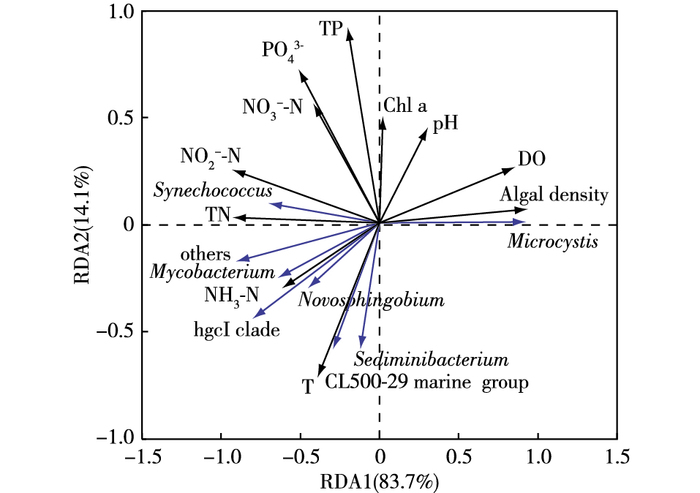
2.5 浮游细菌群落组成与环境因子的相关性分析环境因子对水体中细菌群落结构有着重要影响[39]。选取物种相对丰度排名居前10位的属与环境因子进行冗余分析, 结果见图 8。
|
图 8 浮游细菌与环境因子的RDA分析 Figure 8 RDA analysis of relationships between bacterioplanktons and environmental factors Chl a为叶绿素a;TP为总磷;PO43-为磷酸盐;NO3--N为硝态氮;NO2--N为亚硝态氮;TN为总氮;NH3-N为氨氮;T为水温。环境因子箭头连线长短代表该环境因子对物种数据的解释量,箭头连线越长,解释量越大,反之越小;物种箭头连线长度代表该物种被解释量,箭头连线长度越长,被解释量越大,反之越小;箭头连线和排序轴以及箭头连线之间的夹角表示两者之间的相关性,夹角越小,相关性越大,反之越小。 |
微囊藻属(Microcystis)相对丰度与藻密度、DO浓度和pH值呈正相关; 聚球藻属(Synechococcus)与NO2--N浓度和TN浓度呈正相关, 而与藻密度和DO浓度呈负相关; 结核分枝杆菌属(Mycobacterium)、新鞘脂菌属(Novosphingobium)、hgcI clade、CL500-29 marine group和土壤杆菌属(Sediminibacterium)与NH3-N浓度和水温呈正相关, 而与pH值、DO浓度和藻密度呈负相关。笔者研究表明藻密度、DO浓度和pH值是冬季竺山湾水体中微囊藻属的主要影响因子。因此, 监测藻密度、DO浓度和pH值等环境因子, 对太湖蓝藻暴发尤其是微囊藻属引起的水华预警具有一定价值。
3 结论基于16S rRNA高通量测序技术对太湖竺山湾浮游细菌和沉积物细菌群落结构与多样性进行研究, 并选取属水平优势细菌与环境因子进行相关性分析, 得出以下结论:
(1) 在水样中, 蓝藻细菌门为门水平的优势细菌, 可为今后蓝藻水华暴发的预警提供依据。此外, 其他门水平优势细菌的相对丰度从高到低依次为放线菌门、变形菌门和拟杆菌门。属水平优势细菌主要为微囊藻属和hgcI clade。
(2) 在沉积物中, 门水平优势细菌主要为绿弯菌门、蓝藻细菌门和变形菌门, 其他优势门类细菌为硝化螺旋菌门、酸杆菌门、放线菌门和芽单胞菌门等; 属水平优势细菌主要为微囊藻属和未分类的硝化螺旋菌属。
(3) 竺山湾水样中浮游细菌微囊藻属相对丰度与藻密度、DO浓度和pH值呈正相关, 可为更深入研究微囊藻属与环境因子的生态耦合关系, 控制以微囊藻属为主的太湖水华提供一定的基础数据。
| [1] |
DENG J C, CHEN F, LIU X, et al. Horizontal Migration of Algal Patches Associated With Cyanobacterial Blooms in an Eutrophic Shallow Lake[J]. Ecological Engineering, 2016, 87: 185-193. DOI:10.1016/j.ecoleng.2015.12.017 (  0) 0) |
| [2] |
ZHOU Y Q, JEPPESEN E, ZHANG Y L, et al. Chromophoric Dissolved Organic Matter of Black Waters in a Highly Eutrophic Chinese Lake:Freshly Produced From Algal Scums?[J]. Journal of Hazardous Materials, 2015, 299: 222-230. DOI:10.1016/j.jhazmat.2015.06.024 (  0) 0) |
| [3] |
LIU Y, XU Y, WANG Z J, et al. Dominance and Succession of Microcystis Genotypes and Morphotypes in Lake Taihu, a Large and Shallow Freshwater Lake in China[J]. Environmental Pollution, 2016, 219: 399-408. DOI:10.1016/j.envpol.2016.05.021 (  0) 0) |
| [4] |
LI W, QIN B Q, ZHU G W. Forecasting Short-Term Cyanobacterial Blooms in Lake Taihu, China, Using a Coupled Hydrodynamic-Algal Biomass Model[J]. Ecohydrology, 2014, 7(2): 794-802. DOI:10.1002/eco.v7.2 (  0) 0) |
| [5] |
WANG P F, WANG Y X, WANG C, et al. Ecological Characteristics and Environmental Factors of Phytoplankton During Different Seasons and in Different Parts of Taihu Lake[J]. Fundamental and Applied Limnology, 2015, 187(1): 33-42. DOI:10.1127/fal/2015/0724 (  0) 0) |
| [6] |
WANG P F, HU B, WANG C, et al. Phosphorus Adsorption and Sedimentation by Suspended Sediments From Zhushan Bay, Taihu Lake[J]. Environmental Science and Pollution Research, 2015, 22(9): 6559-6569. DOI:10.1007/s11356-015-4114-6 (  0) 0) |
| [7] |
LIU Y, PENG Y K, YUE D M, et al. Assessment of Heavy Metal Enrichment, Bioavailability, and Controlling Factors in Sediments of Taihu Lake, China[J]. Soil and Sediment Contamination:An International Journal, 2015, 24(3): 262-275. DOI:10.1080/15320383.2015.948610 (  0) 0) |
| [8] |
SU X M, STEINMAN A D, XUE Q J, et al. Temporal Patterns of Phyto-and Bacterioplankton and Their Relationships With Environmental Factors in Lake Taihu, China[J]. Chemosphere, 2017, 184: 299-308. DOI:10.1016/j.chemosphere.2017.06.003 (  0) 0) |
| [9] |
向燕, 刘国锋, 刘正文. 微囊藻水华叠加对太湖沉积物中细菌垂直分布的影响[J]. 水生态学杂志, 2011, 32(6): 20-25. XIANG Yan, LIU Guo-feng, LIU Zheng-wen. Effect of Microcystis spp. Bloom Deposition on Vertical Distribution of Bacteria in Sediment Core of Algae-Type Region in Taihu Lake[J]. Journal of Hydroecology, 2011, 32(6): 20-25. (  0) 0) |
| [10] |
SHAO K Q, GAO G, WANG Y P, et al. Vertical Diversity of Sediment Bacterial Communities in Two Different Trophic States of the Eutrophic Lake Taihu, China[J]. Journal of Environmental Sciences, 2013, 25(6): 1186-1194. DOI:10.1016/S1001-0742(12)60122-3 (  0) 0) |
| [11] |
刘燕, 张振华, 鲍王波, 等. 青霉素对土壤微生物群落结构的影响[J]. 生态与农村环境学报, 2016, 32(2): 309-314. LIU Yan, ZHANG Zhen-hua, BAO Wang-bo, et al. Effects of Penicillin on Soil Microbial Community Structure[J]. Journal of Ecology and Rural Environment, 2016, 32(2): 309-314. DOI:10.11934/j.issn.1673-4831.2016.02.021 (  0) 0) |
| [12] |
ZHAO D Y, HUANG R, ZENG J, et al. Diversity Analysis of Bacterial Community Compositions in Sediments of Urban Lakes by Terminal Restriction Fragment Length Polymorphism(T-RFLP)[J]. World Journal of Microbiology & Biotechnology, 2012, 28(11): 3159-3170. (  0) 0) |
| [13] |
黄睿, 沈烽, 罗娟, 等. 蓝藻水华消亡对湖泊表层沉积物中氨氧化细菌丰度和群落结构的影响[J]. 生态与农村环境学报, 2015, 31(3): 334-339. HUANG Rui, SHEN Feng, LUO Juan, et al. Effects of Withering of Cyanobacteria Bloom on Abundance and Community Composition of Ammonia-Oxidizing Bacteria in Surface Lake Sediments[J]. Journal of Ecology and Rural Environment, 2015, 31(3): 334-339. DOI:10.11934/j.issn.1673-4831.2015.03.010 (  0) 0) |
| [14] |
邸攀攀, 张力, 王岩, 等. 微生物固定化技术对污水中微生物丰度变化的影响[J]. 生态与农村环境学报, 2015, 31(6): 942-949. DI Pan-pan, ZHANG Li, WANG Yan, et al. Effect of Microorganism Immobilization Techniques on Microorganism Abundances in Polluted Ponds[J]. Journal of Ecology and Rural Environment, 2015, 31(6): 942-949. DOI:10.11934/j.issn.1673-4831.2015.06.022 (  0) 0) |
| [15] |
RINKE C, SCHWIENTEK P, SCZYRBA A, et al. Insights Into the Phylogeny and Coding Potential of Microbial Dark Matter[J]. Nature, 2013, 499(7459): 431-437. DOI:10.1038/nature12352 (  0) 0) |
| [16] |
DAI Y, YANG Y Y, WU Z, et al. Spatio-temporal Variation of Planktonic and Sediment Bacterial Assemblages in Two Plateau Freshwater Lakes at Different Trophic Status[J]. Applied Microbiology and Biotechnology, 2016, 100(9): 4161-4175. DOI:10.1007/s00253-015-7253-2 (  0) 0) |
| [17] |
FAN L, SONG C, MENG S, et al. Spatial Distribution of Planktonic Bacterial and Archaeal Communities in the Upper Section of the Tidal Reach in Yangtze River[J]. Scientific Reports, 2016, 6: 39147. DOI:10.1038/srep39147 (  0) 0) |
| [18] |
LI J F, ZHANG J Y, LIU L Y, et al. Annual Periodicity in Planktonic Bacterial and Archaeal Community Composition of Eutrophic Lake Taihu[J]. Scientific Reports, 2015, 5: 15488. DOI:10.1038/srep15488 (  0) 0) |
| [19] |
FAN X, XING P. The Vertical Distribution of Sediment Archaeal Community in the "Black Bloom" Disturbing Zhushan Bay of Lake Taihu[J]. Archaea, 2016, 8232135. (  0) 0) |
| [20] |
KUCZYNSKI J, STOMBAUGH J, WALTERS W A, et al.Using QⅡME to Analyze 16S rRNA Gene Sequences From Microbial Communities[M]//Current Protocols in Bioinformatics.Hoboken, New Jersey, USA:John Wiley & Sons, Inc., 2011:10.7.1-10.7.20.
(  0) 0) |
| [21] |
TER BRAAK C J F, ŠMILAUER P.CANOCO Reference Manual and CanoDraw for Windows User's Guide:Software for Canonical Community Ordination(Version 4.5)[R].Ithaca, NY, USA:Microcomputer Power, 2002.
(  0) 0) |
| [22] |
环境保护部办公厅. 关于印发《地表水环境质量评价办法(试行)》的通知: 环办[2011] 22号[A/OL]. (2011-03-09)[2017-07-20]. http://www.zhb.gov.cn/gkml/hbb/bgt/201104/t20110401_208364.htm. General Office of the Ministry of Environmental Protection. Circular on Evaluation Method of Surface Water Quality(for Trial Implementation): [2011] No. 22[A/OL]. (2011-03-09)[2017-07-20].http://www.zhb.gov.cn/gkml/hbb/bgt/201104/t20110401_208364.htm. (  0) 0) |
| [23] |
华伟, 张雪, 蒋福春, 等. 高pH值太湖原水应对技术研究及应用[J]. 供水技术, 2015, 9(3): 36-40. HUA Wei, ZHANG Xue, JIANG Fu-chun, et al. Study and Application of Method Coping With the High pH Raw Water From Taihu Lake[J]. Water Technology, 2015, 9(3): 36-40. (  0) 0) |
| [24] |
POMMIER T, CANBÄCK B, RIEMANN L, et al. Global Patterns of Diversity and Community Structure in Marine Bacterioplankton[J]. Molecular Ecology, 2007, 16(4): 867-880. (  0) 0) |
| [25] |
陈兆进, 丁传雨, 朱静亚, 等. 丹江口水库枯水期浮游细菌群落组成及影响因素研究[J]. 中国环境科学, 2017, 37(1): 336-344. CHEN Zhao-jin, DING Chuan-yu, ZHU Jing-ya, et al. Community Structure and Influencing Factors of Bacterioplankton During Low Water Periods in Danjiangkou Reservoir[J]. China Environmental Science, 2017, 37(1): 336-344. (  0) 0) |
| [26] |
FANG L, CHEN L, LIU Y, et al. Planktonic and Sedimentary Bacterial Diversity of Lake Sayram in Summer[J]. Microbiologyopen, 2015, 4(5): 814-825. DOI:10.1002/mbo3.2015.4.issue-5 (  0) 0) |
| [27] |
丁轶睿, 李定龙, 张毅敏, 等. 滆湖底泥细菌群落结构及多样性[J]. 环境科学学报, 2017, 37(5): 1649-1656. DING Yi-rui, LI Ding-long, ZHANG Yi-min, et al. The Structure and the Diversity of Sediment Microbial Communities in Gehu Lake[J]. Acta Scientiae Circumstantiae, 2017, 37(5): 1649-1656. (  0) 0) |
| [28] |
SONG H, XU J H, LAVOIE M, et al. Biological and Chemical Factors Driving the Temporal Distribution of Cyanobacteria and Heterotrophic Bacteria in a Eutrophic Lake(West Lake, China)[J]. Applied Microbiology and Biotechnology, 2016, 101(4): 1685-1696. (  0) 0) |
| [29] |
薛银刚, 蒋聪, 耿金菊, 等. 基于qPCR和16S rDNA高通量测序研究蓝藻暴发期间太湖竺山湾水体浮游细菌群落[J]. 环境监控与预警, 2017, 9(3): 19-23. XUE Yin-gang, JIANG Cong, GENG Jin-ju, et al. Profiles of Bacterioplankton Based on qPCR and 16S rDNA High Throughput Sequencing During a Heavy Cyanobacterial Bloom in Zhushan Bay, Taihu Lake[J]. Environmental Monitoring and Forewarning, 2017, 9(3): 19-23. (  0) 0) |
| [30] |
YE W J, LIU X L, LIN S Q, et al. The Vertical Distribution of Bacterial and Archaeal Communities in the Water and Sediment of Lake Taihu[J]. FEMS Microbiology Ecology, 2009, 70(2): 107-120. (  0) 0) |
| [31] |
ZHANG J Y, ZHU C M, GUAN R, et al. Microbial Profiles of a Drinking Water Resource Based on Different 16S rRNA V Regions During a Heavy Cyanobacterial Bloom in Lake Taihu, China[J]. Environmental Science and Pollution Research International, 2017, 24(14): 12796-12808. DOI:10.1007/s11356-017-8693-2 (  0) 0) |
| [32] |
DANIEL L M C, POZZI E, FORESTI E, et al. Removal of Ammonium Via Simultaneous Nitrification-Denitrification Nitrite-Shortcut in a Single Packed-Bed Batch Reactor[J]. Bioresource Technology, 2009, 100(3): 1100-1107. DOI:10.1016/j.biortech.2008.08.003 (  0) 0) |
| [33] |
SHAO K, GAO G, QIN B Q, et al. Comparing Sediment Bacterial Communities in the Macrophyte-Dominated and Algae-Dominated Areas of Eutrophic Lake Taihu, China[J]. Canadian Journal of Microbiology, 2011, 57(4): 263-272. DOI:10.1139/w11-003 (  0) 0) |
| [34] |
吴鑫, 奚万艳, 杨虹. 太湖梅梁湾冬季浮游细菌的多样性[J]. 生态学杂志, 2006, 25(10): 1196-1200. WU Xin, XI Wan-yan, YANG Hong. Bacterioplankton Diversity in Meiliang Bay of Taihu Lake in Winter[J]. Chinese Journal of Ecology, 2006, 25(10): 1196-1200. DOI:10.3321/j.issn:1000-4890.2006.10.009 (  0) 0) |
| [35] |
XU H, PAERL H W, QIN B Q, et al. Nitrogen and Phosphorus Inputs Control Phytoplankton Growth in Eutrophic Lake Taihu, China[J]. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 (  0) 0) |
| [36] |
SUN Z, LI G P, WANG C W, et al. Community Dynamics of Prokaryotic and Eukaryotic Microbes in an Estuary Reservoir[J]. Scientific Reports, 2014, 4: 6966. (  0) 0) |
| [37] |
LIU J W, FU B B, YANG H M, et al. Phylogenetic Shifts of Bacterioplankton Community Composition Along the Pearl Estuary:The Potential Impact of Hypoxia and Nutrients[J]. Frontiers in Microbiology, 2015, 6: 64. (  0) 0) |
| [38] |
寇文伯, 黄正云, 张杰, 等. 鄱阳湖湖泊细菌群落组成及结构:以松门山为例[J]. 生态学报, 2015, 35(23): 7608-7614. KOU Wen-bo, HUANG Zheng-yun, ZHANG Jie, et al. Bacterial Community Structure and Composition in Lake Poyang:A Case Study in the Songmenshan Region, China[J]. Acta Ecologica Sinica, 2015, 35(23): 7608-7614. (  0) 0) |
| [39] |
HALLER L, TONOLLA M, ZOPFI J, et al. Composition of Bacterial and Archaeal Communities in Freshwater Sediments With Different Contamination Levels(Lake Geneva, Switzerland)[J]. Water Research, 2011, 45(3): 1213-1228. DOI:10.1016/j.watres.2010.11.018 (  0) 0) |




