阿尔茨海默氏病(Alzheimer's Disease, AD)是一种严重的脑疾病[1]。由于社会老龄化,有研究预测,到2050年,每85个人中有1人将受这种疾病的影响[2]。AD的主要临床症状包括一些重要的大脑认知和智力能力的下降, 更严重的会导致记忆丧失以及行为变化、说话困难,行走及吞咽困难,严重干扰日常生活。由于特定的神经细胞变性、神经炎性斑块和神经纤维缠结的存在,随着时间的推移,这些临床症状会加剧[3]。这种疾病严重干扰患者的日常生活,并最终会导致死亡,到目前为止,还没有任何有效的临床治疗方法。在过去的十几年中,研究人员已经使用神经影像学技术来研究AD的生物学标志物[4-5]。随着图论的不断发展,对AD患者的功能性脑网络的拓扑结构的研究不断增多[6-7]。
静息态的功能磁共振成像采用血氧水平依赖(Blood Oxygenation Level Dependency, BOLD)信号作为神经电生理指标,能够检测大脑自发低频神经活动,揭示与抑郁症有关的神经活动,已成功应用于AD的诊断[8]。在传统的静息态功能磁共振成像分析中,忽略了两个脑区之间的相关性可能受到其他脑区之间的功能连接的影响; 同时,随着复杂脑网络分析的深入,传统的大脑区域之间的功能连接的建立方法已经无法满足对网络中更深层次的交互信息的研究。已经有研究试图通过更复杂的方法来建立大脑区域之间的关联程度。例如: Plis等[9]使用基于信息理论的方法,通过互信息的方法来研究大脑区域之间的非线性关系; Jie等[10]提出了使用超网络来构建大脑功能连接网络的方法,将超图模型引入到网络中来,用来表明多个脑区之间的交互信息。越来越多的研究试图寻找更精确、更有效的方法来构建人脑的功能连接网络,以弥补传统功能连接网络构建方法的缺陷。
最小生成树(Minimum Spanning Tree, MST)算法是图论中的经典算法之一。通过最小生成树可以得到图的概要信息和索引结构,去除冗余的信息。Tewarie等[11]提出将最小生成树运用于脑网络的分析中,研究了脑网络的整个拓扑结构。目前,最小生成树方法已经被广泛应用在神经影像领域的研究中。
本文的创新之处在于,提出了一种构建高阶最小生成树功能连接网络的方法。与传统的功能连接网络相比,本文所构建的功能连接网络可以更精确地揭示大脑区域之间的交互信息,构建的功能连接考虑到了多个脑区的影响,因此构建的功能连接可以更好地反映两个脑区之间的交互;同时,本文使用了最小生成树的方式来简化构建的高阶功能连接网络,去除网络中冗余的功能连接,在保留网络的生理学意义的同时,发现更精确地用于AD检测的生物学标志物。分类结果显示,基于高阶最小生成树功能连接网络的分类方法极大地提高了AD检测的准确率。
1 实验材料及方法 1.1 数据采集和预处理本实验共招募66名被试,其中有38名AD患者,28名年龄性别匹配的健康志愿者作为对照组。本研究是按照山西省医学伦理委员会(参考编号:2012013)和赫尔辛基宣言的建议,在所有受试者书面知情同意的情况下进行的。所有AD患者进行了全面的身体和神经系统检查,并进行了广泛的神经心理评估,所有AD患者符合符合国家老年痴呆症协会的诊断标准[3]。使用西门子3T超导MRI扫描仪(Siemens Trio 3-Tesla Scanner,Siemens,Erlangen,Germany)对28名健康右利手志愿者和38名AD被试进行静止状态功能磁共振扫描,被试基本信息如表 1所示。简易精神量表(Mini-Mental State Examination,MMSE)用来表征患者患病程度。统计分析来评估组间差异。数据的采集工作是由山西医科大学第一医院完成的,所有的扫描工作由熟悉磁共振操作的放射科医生来完成。在扫描的过程中,要求被试闭眼、放松、不去想特定的事物但要保持清醒不能睡着。扫描参数设置如下:33 axial slices, repetition time (TR)=2000 ms, echo time (TE)=30 ms, thickness/skip=4/0 mm, field of view (FOV)=192 mm×192 mm, matrix=64 mm×64 mm, flip angle=90°, 248 volumes。
| 表 1 被试基本信息统计 Table 1 Statistics of basic information of the subjects |
数据预处理使用SPM8 (http://www.fil.ion.ucl.ac.uk/spm)进行, 主要包含时间层矫正、头动校正、联合配准、空间标准化、低频滤波、平滑。首先,对数据集进行时间片校正和头动校正, 2例AD组及1例对照组数据由于校正过程中,头动大于3 mm或转动大于3°而被弃除。弃除的被试不包括在66名被试中; 之后,图像进行12维度的优化仿射变换,将其标准化到3 mm体素的MNI(Montreal Neurological Institute)标准空间中; 然后,进行低频滤波(0.06~0.11 Hz),以降低低频漂移及高频的生物噪声; 最后,进行空间平滑,进一步消除被试脑形态结构的细微差异以及在图像重构时造成的误差。
1.2 方法框架基于高阶最小生成树功能连接网络的静息态功能磁共振影像数据分类方法包括以下5个步骤:
1) 数据采集及预处理。采集正常被试和AD被试的静息态的功能磁共振成像数据进行数据预处理。
2) 高阶功能连接网络的构建。根据模板划分脑区,提取每个脑区的平均时间序列。计算两两时间序列之间的皮尔逊相关系数。对于每一个脑区,与其他所有脑区的皮尔逊相关系数可以构成一个序列。再次计算两两时间序列的皮尔逊相关系数,构建功能连接。需要强调的是,第二次计算皮尔逊相关系数时,计算任意两个脑区之间的皮尔逊相关系数时,每一个脑区的序列是一个由88个值构成的序列,且在构建不同脑区之间的功能连接时,这个序列是变化的。
3) 高阶最小生成树功能连接网络的构建。构建高阶功能连接网络后,这个网络实际上是一个全连接的加权网络,为了对这个网络进行稀疏化、去除冗余的功能连接,本研究使用最小生成树的方法对网络进行稀疏化,去除网络中冗余的功能连接,使用最小生成树的方法可以极大地保留网络中的核心结构,不影响对网络的整体分析。
4) 特征定义及特征选择。构建了高阶最小生成树功能连接网络之后,网络中每个节点的加权局部聚类系数被定义为特征,使用两两冗余的Relief特征选择方法,选择重要的特征集合。即首先采用Relief特征选择方法得到特征集合,然后,针对Relief特征选择方法无法有效地去除冗余特征的缺点,使用计算皮尔逊相关系数的方法对Relief特征选择得到的特征集合进行冗余分析,去除特征集合中相关性比较强的特征中分类权重较低的特征,从而得到最终的特征集合。
5) 分类器的构建。本文使用支持向量机的方法进行分类,并使用10折交叉验证的方法验证分类器的泛化性能。
1.3 网络构建根据AAL(Anatomical Automatic Labeling)[12]模板将大脑划分为90个(左右半脑各45个)脑区,每个脑区代表功能脑网络中一个独立节点。根据划分的90个脑区,计算每个脑区中所包含的所有体素的血氧水平依赖(BOLD)信号的算术平均值,表征该节点的信号值。选择每个脑区所包含的所有体素在不同时间点上的激活信号,再将各体素在不同时间点上的激活信号进行算术平均,得到脑区的平均时间序列。
得到每个脑区的平均时间序列之后,假设第l个被试的第i个脑区的时间序列用xi(l)表示, 第l个被试的第j个脑区的时间序列用xj(l)表示,则xi(l)和xj(l)之间的相关程度可以由如下公式得到:
| $ C_{ij}^{\left( l \right)} = corr\left( {x_i^{\left( l \right)}, x_j^{\left( l \right)}} \right) $ | (1) |
其中:corr表示皮尔逊相关系数。对于每一个被试,一共划分90个脑区,通过式(1)可以计算两两脑区之间的皮尔逊相关系数。
在构建第l个被试的第i个脑区和第j个脑区之间功能连接时,对于第i个脑区,与除第i和第j个脑区外88个脑区之间的皮尔逊相关系数可以组成一个新的序列Li,对于第j个脑区,与除第i和第j个脑区外88个脑区之间的皮尔逊相关系数可以组成一个新的序列Lj,则第l个被试的第i个脑区和第j个脑区之间的相关程度可以由如下公式得到:
| $ \overline C _{ij}^{\left( l \right)} = corr\left( {L_i^{\left( l \right)}, L_j^{\left( l \right)}} \right) $ | (2) |
即再次计算Li和Lj之间的皮尔逊相关系数可以得到脑区i和脑区j之间的功能连接权重。以i和j作为顶点,以
构建了高阶功能连接网络之后,实际上这个网络是一个全连接的加权网络,为了对这个网络进行稀疏化,简化网络中的功能连接,保留对网络特性影响较大的功能连接,本研究使用最小生成树的方法对网络G(l)进行简化,得到总权重最小的生成树,这样就得到了高阶最小生成树功能连接网络。使用最小生成树的方法在保留网络中所有节点的情况下,极大地保留网络中的核心结构,去除冗余的、对网络结构影响较小的连接,而且不影响对网络的整体分析。
1.4 特征定义及特征选择构建了高阶最小生成树功能连接网络后,本研究将网络中每个节点的加权局部聚类系数[13]定义为特征,计算了高阶最小生成树功能连接网络中每个顶点的加权局部聚类系数。
在传统的大脑功能连接网络节点分析中,除了节点的加权局部系数这一指标外,常用的指标还有节点的度、节点效率、节点介数等。本研究提出了基于高阶最小生成树的磁共振数据分类方法,重点在于提出了高阶最小生成树功能连接网络的构建方法,研究大脑区域之间更深层次的交互信息。同时,基于加权局部聚类系数能很好地表现复杂网络中节点的聚集程度[14],并能更好地反映脑网络中每个节点及节点周围的患病情况[13],所以,本研究选择将网络中每个节点的加权局部聚类系数定义为特征。
局部聚类系数被广泛地应用在生物学的研究中[13-15],可以很好地检测网络中节点的重要性,尤其是在脑功能连接的研究中[13, 15]。加权局部聚类系数表现了复杂网络中节点的聚集程度,反映了节点周围的组织情况[14],应用于脑网络的研究中能更好地反映每个节点周围的患病情况[13]。人脑的功能连接网络具有小世界属性,每个节点与周围节点易形成相对紧密的连接,因此,衡量脑网络中每个节点周围的聚集程度对脑疾病的检测具有重要意义。在本研究中,使用加权局部聚类系数这一参数来分析静息态功能连接网络,可以在保留功能连接网络的生理学意义的同时,更好地反映网络中每个节点及节点周围的异常情况,对研究AD患者的异常脑区具有重要的意义[13, 15]。其数学定义如下:
| $ {f_i} = \frac{{2\sum\limits_{j:j \in {\mathit{\Delta} _i}} {{w_{ij}}} }}{{|{\mathit{\Delta} _i}|\left( {|{\mathit{\Delta} _i}|-1} \right)}} $ | (3) |
其中:Δi表示连接到顶点i的所有顶点的集合,|Δi|表示连接到顶点i的所有顶点的数目,wij表示连接顶点i和顶点j的边的权重。
特征选择就是从整个特征集合中选择最具代表性的特征子集,特征选择方法可以用来识别和删除不需要的数据,去除冗余的特征,有助于建立准确的预测模型。本文采用Relief特征选择方法,依据特征之间的相关性分配给每个特征不同的权值,然后根据设置的阈值筛选特征,从而产生一个新的特征集合。该算法主要应用于两类数据的分类。基于此特点,该方法适用于AD患者和正常人的分类。然而,Relief特征选择算法的主要缺点是不能有效去除冗余特征。考虑到这一问题,本研究首先使用Relief特征选择算法得到特征集合,然后,为了去除冗余特征,计算了得到的特征集合中两两特征之间的皮尔逊相关系数,去除Relief特征选择算法得到的特征集合中,相关性强的特征中分类权重较小的特征,从而得到最终的特征集合。
1.5 分类器的构建支持向量机通过非线性变化将原始数据转化到一个高维的特征空间,寻求一个最大化类间间隔的超平面,将一个类的样本与其他类的样本相分离。它在处理高维、非线性、小样本数据时具有独特的优势。本文使用基于径向基函数(Radial Basis Function, RBF)核函数方法的支持向量机(Support Vector Machine, SVM)[16]进行分类。然后使用100次10折交叉验证(10-fold cross validation)的方法[16]评估构建的分类器的性能。具体来说,将包含L个被试的数据集随机地分成10个部分,逐一将其中的一个部分作为测试集,其余9份作为训练集。本实验使用基于Matlab的LIBSVM工具包[16]进行。
2 实验结果与分析 2.1 分类结果传统的功能连接网络包括偏相关功能连接网络和皮尔逊相关功能连接网络。为了比较本文方法与传统方法的差异,表 2比较了不同分类方法的准确率、特异性和敏感性。此外,由于不同的研究都是在不同的数据集下得到的,同样的方法使用不同的数据集可能得到不同的分类的结果,并且,不同的研究之间不仅构建网络的方法不同,特征提取方法和分类方法也存在差异。为了更精确地比较不同的构建功能连接网络的方法,本文在相同的数据集上,分别构建了偏相关功能连接网络、皮尔逊相关功能连接网络和高阶最小生成树功能连接网络,并将每个网络中节点的加权局部聚类系数定义为特征,使用相同的特征选择方法和分类器构建方法,比较不同分类方法的分类结果,结果如表 2所示。
| 表 2 不同功能连接网络分类结果比较 Table 2 Comparison of different function connection network classification results |
分类结果表明,使用本方法构建的网络明显优于使用传统方法构建的网络。与传统的皮尔逊相关功能连接网络相比,本方法在构建功能连接时,将其他脑区的影响考虑到功能连接的构建中,分类结果显示,在相同的数据集下,本方法的分类准确率提高了大约20%。此外,传统的偏相关功能连接网络的构建方法是计算两个脑区的平均时间序列之间的偏相关系数,在计算时也考虑了其余脑区的影响,但是,分类结果表明,在相同的数据集下,本方法的分类结果更好,准确率更高。与Chen等[17]的分类结果相比,本文的高阶最小生成树功能连接网络对AD的检测准确率提高了大约13%,此外,表 2还对比了不同的方法在不同疾病下的分类结果,其中,MDD表示抑郁症,eMCI表示轻度认知障碍。总体来看,本方法的分类准确率更高。从分类结果可以看出,高阶最小生成树功能连接网络能更好地衡量脑区之间的关联程度,更有效、更精确地构建脑区之间的功能连接。同时,使用最小生成树的方式可以有效地稀疏化网络,有效去除冗余的连接,得到关键的核心网络,从而使分类结果更好、更准确。结果表明基于高阶最小生成树功能连接网络的分类方法可以很好地区分AD患者和正常人。
2.2 具有判别性的脑区本文计算了高阶最小生成树功能连接网络中每个节点的局部聚类系数,通过特征选择得到了最终的特征集合。图 1显示了本方法得到的8个最具判别性的脑区,包括左侧海马(Left hippocampus, HIP.L)、左侧楔前叶(Left precuneus, PCUN.L)、左侧杏仁核(Left amygdala, AMYG.L),右侧楔叶(Right cuneus, CUN.R)、右侧脑岛(Right insula, INS.R)、左侧顶上回(Left Superior Parietal Gyrus, SPG.L)、左尾状核(Left caudate nucleus, CAU.L)和右后扣带回(Right Posterior Cingulate Gyrus, PCG.R)。图中节点的大小表示脑区的权值(在Relief特征选择算法中,为每个脑区赋予不同的权重值)。
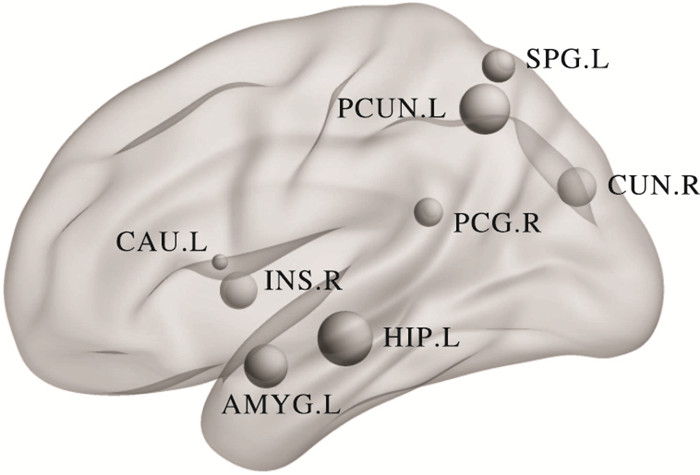
|
图 1 具有判别性的脑区 Figure 1 Discriminative brain regions |
这些最具判别力的脑区对AD的检测具有重要的意义。本研究得到的判别性脑区均在之前的研究中被证明与AD有着重要的关联。其中,左侧海马的权重明显高于其他脑区。AD的特点是海马严重萎缩,导致患者出现偶发性记忆障碍。在AD中,海马也是第一个被破坏的区域,表现为记忆障碍和严重认知障碍。有研究认为海马失忆症是AD的检测中不可或缺的核心特征。文献[20-21]表明左侧海马在AD的病发中起重要作用。Aggleton等[20]的研究指出了与AD有关的重要脑区,研究发现,海马在人脑的信息处理过程中扮演着重要的角色,海马能够帮助人类进行学习、记忆和事物处理,它与人类的记忆功能有着极其很重要的关联。Zamboni等[21]研究了30名AD被试和25名正常被试在静息态和任务态下不同大脑区域的激活情况的差异,研究结果表明,无论在静息态还是任务态,AD患者大脑左侧海马的激活情况与正常被试存在显著差异。楔前叶是大脑默认网络的一部分,楔前叶与人类许多高水平的记忆和认知功能有着重要的关联,此外,楔前叶与人类的情景记忆、记忆的处理、信息的加工和处理、情感的调节和意识的形成有着重要的关联。现有研究表明,楔前叶也是鉴别AD的一个重要的生物标志物[21]。此外,杏仁核是人脑的一个重要的区域,与情绪加工、记忆形成、情绪调节等具有重要的关联,和海马相似,杏仁核对记忆的形成和认知有关,具有情绪意义的刺激会引发杏仁核的激活变化,并在人脑形成长期存储的记忆片段。Grady等[22]发现AD患者的左侧杏仁核的活动与记忆表现呈正相关,AD患者的杏仁核激活情况与正常人存在显著差异。此外,他们的研究还发现右侧楔叶也是研究AD患者的重要脑区之一。Sun等[23]研究正常被试和AD患者的脑功能连接网络,发现了包括左侧顶上回和左侧尾状核在内的多个异常脑区。其他主要的判别性脑区,包括右侧脑岛[24]和右侧后扣带回[21]也与之前的研究结果一致。
3 方法论本文所提出的分类方法的性能依赖于一些参数和算法的选择,例如最小生成树算法的选择、特征选择中的权重阈值δ和相关系数阈值λ的选择、SVM模型中惩罚因子C和核函数中的核参数γ的选择。这些参数的选择对结果有着重要的影响。本章将依次分析不同参数和算法的选择对分类结果的影响。
3.1 不同最小生成树算法对分类结果的影响在得到无向加权的高阶功能连接网络之后,本文使用最小生成树的方法对网络进行稀疏化。在保留网络所有节点的同时,删除网络中冗余的、对网络影响较小的功能连接,从而得到高阶最小生成树功能连接网络。一个无向加权图的最小生成树是不唯一的,使用的最小生成树算法不同,得到的生成树也不相同。为了研究不同最小生成树算法对构建的高阶最小生成树和最终的分类结果的影响,本研究分别使用了Prim算法和Kruskal算法对高阶功能连接网络进行简化。Prim算法和Kruskal算法都能求解无向加权图的最小生成树: Prim算法从图的顶点出发,每次选择距离当前顶点最近的顶点,直到加入所有节点; Kruskal算法从边出发,每次总是选择权重最小的边加入。为了验证这两种算法对实验结果的影响,在相同的数据集下,本研究分别构建了基于Prim算法的高阶最小生成树功能连接网络和基于Kruskal算法的高阶最小生成树功能连接网络,并定义网络中每个节点的加权局部聚类系数为特征,使用两两冗余的Relief特征选择方法进行特征选择,构建基于RBF核函数的SVM分类器,分类结果如表 3所示。
| 表 3 不同最小生成树算法对分类结果的影响 Table 3 Effects of different MST algorithms on classification results |
从分类结果可以看出,基于Kruskal算法的高阶最小生成树功能连接网络的分类结果优于基于Prim算法的高阶最小生成树功能连接网络的分类结果。实验结果表明,使用Kruskal算法可以更好地去除高阶功能连接网络中的冗余连接,更有效地对网络进行稀疏化。所以,本实验采用Kruskal最小生成树算法来构建高阶功能连接网络。
3.2 特征选择参数对分类结果的影响在特征选择的过程中,本文首先采用Relief特征选择方法,计算每个特征的权重,根据设定的阈值对特征进行筛选,得到特征集合,同时,针对Relief特征选择方法不能去除冗余特征的缺点,对特征集合进行两两冗余分析,通过计算皮尔逊相关系数,将相关性强的特征中分类权重较小的特征去除,得到最终的特征集合。在整个特征选择过程中,涉及到两个特征选择参数,一个是Relief特征选择中的权重阈值δ,另一个是冗余分析中的相关系数阈值λ。这两个参数的选择,也会对分类结果产生影响。
为了能够选取更精确的权重阈值,根据网络中所有顶点的权重分布,实验选取权重阈值δ∈[1000, 1100, …, 1600],在控制其他参数不变的情况下,研究不同权重阈值对分类结果的影响。分类结果如表 4所示,从分类结果可以看出,在基于高阶最小生成树功能连接网络的分类方法中,当权重阈值为1300时,得到的分类准确率最高。当权重阈值较小时,对分类结果影响较小的特征也被筛选出来,使得分类准确率降低;而当权重阈值较大时,对分类贡献较大的特征将会被移除,分类准确率也会下降。
| 表 4 不同权重阈值对分类结果的影响 Table 4 Influence of different weight threshold on classification results |
Relief特征选择方法具有简单、效率高的特点,但该方法的局限性在于无法有效地去除冗余的特征。针对这一缺点,本实验使用相关分析的方法对Relief特征选择得到的特征集合进行两两冗余分析,通过计算皮尔逊相关系数,去除特征集合中的冗余特征,从而得到最终的特征集合。在这一过程中,涉及到相关系数阈值λ的选取。本实验选取相关系数阈值λ∈[0.75, 0.8, …, 0.95],在控制其他参数不变的情况下,研究了不同相关系数阈值对分类结果的影响。
分类结果如表 5所示,从分类结果可以看出,当相关系数阈值为0.9时,得到的分类准确率最高。这可以从两方面理解:一方面,当选取的相关系数阈值较小时,并不能很好地去除特征集合中的冗余特征,因为有冗余特征的存在,分类的准确率就会下降;另一方面,当选取的相关系数阈值较大时,对分类结果影响较大的关键特征也会被移除,由于重要特征的缺失,分类的准确率也会下降。但是,从总体上来看,相关系数阈值对分类的准确率影响并不是很大,这主要是因为两两冗余分析的目的是去除冗余特征,而使用最小生成树稀疏化网络,可以有效地去除冗余的特征,使用Relief特征选择方法得到的特征集合中,存在的冗余特征较少,所以不同的相关系数阈值对分类的准确率影响较小。这说明了高阶最小生成树功能连接网络中存在的冗余功能连接较少,能更好地用于AD被试和正常被试的检测。
| 表 5 不同相关系数阈值对分类结果的影响 Table 5 Influence of different correlation coefficient threshold on classification results |
SVM分类模型中,存在两个非常重要的参数,即惩罚因子C和RBF核函数中的核参数γ,它们是影响SVM性能的关键因素[18, 25]。其中,惩罚因子C可以调节数据子空间中的置信区间的范围:当惩罚因子C过大时,对误差的容忍度较低,容易出现过拟合的情况,避免过拟合是分类器设计中的一项核心任务; 当惩罚因子C过小时,对误差的容忍度较高,容易出现欠拟合的情况,无论是过拟合还是欠拟合,都会使分类器的泛化能力降低,从而对分类的精度产生影响。核参数γ是RBF核函数中的重要参数,它决定了数据映射到高维特征空间的映射函数。
本文使用基于RBF核函数的SVM分类器,其性能由参数(C,γ)决定。对于不同的数据集,使用LIBSVM默认的参数设置并不能得出最优的分类性能。也就是说,针对不同的数据集,要使用不同的参数设置,从而得到最优的分类结果。本文使用基于网格搜索(Gird Search,GS)的SVM参数寻优方法[18],分别选取不同的参数组合,其中,C∈[1, 2, …, 10]、γ∈[0, 0.05, 0.1, …, 0.4, 0.45],采用交叉验证的方式,研究不同参数组合得到的分类器的性能。通过实验得出,在当前数据集下,当C=3、γ=0.2时,分类准确率最高。
4 结语复杂网络理论作为研究复杂系统的重要工具,在脑精神疾病的研究中成为热点。大脑区域之间的功能连接反映了不同大脑区域之间的交互信息,大脑区域之间的功能连接包含着用于AD检测的重要生物学标志物。但是,已有的功能连接构建方法相对单一,无法精确和有效地衡量不同大脑区域之间的关联程度,忽视了不同功能连接之间的相互影响。为了解决现有的问题,本文提出了一种新的构建功能连接网络的方法,能够更好地衡量脑区之间的相关程度,并将最小生成树的方法应用到脑网络的构建中,提出了基于高阶最小生成树的数据分类方法。本文还列举了实验得到的AD病人的判别性脑区,研究了实验过程中不同参数对分类结果的影响,并与现有的构建功能连接网络的方法进行了比较,显示了高阶最小生成树功能连接网络的优越性。具体的优点包括:首先,高阶最小生成树功能连接网络在构建时考虑到了更多脑区之间的交互;其次,本文方法可以研究疾病引起的更深层次大脑区域之间的关联变化;最后,分类的结果显示,与传统的方法相比,基于高阶最小生成树功能连接网络的分类方法大幅提高了AD检测的准确率。
| [1] | ASSOCIATION A. 2010 Alzheimer's disease facts and figures[J]. Alzheimers & Dementia, 2010, 6(2): 158-194. |
| [2] | BROOKMEYER R, JOHNSON E, ZIEGLER-GRAHAM K, et al. Forecasting the global burden of Alzheimer's disease[J]. Alzheimer's & Dementia, 2007, 3(3): 186-191. |
| [3] | MCKHANN G, DRACHMAN D, FOLSTEIN M, et al. Clinical diagnosis of Alzheimer's disease report of the NINCDS-ADRDA work group* under the auspices of department of health and human services task force on Alzheimer's disease[J]. Neurology, 1984, 34(7): 939-939. DOI:10.1212/WNL.34.7.939 |
| [4] | STAM C J, JONES B F, MANSHANDEN I, et al. Magnetoencephalographic evaluation of resting-state functional connectivity in Alzheimer's disease[J]. NeuroImage, 2006, 32(3): 1335-1344. DOI:10.1016/j.neuroimage.2006.05.033 |
| [5] | ZHOU B, YAO H, WANG P, et al. Aberrant functional connectivity architecture in Alzheimer's disease and mild cognitive impairment:a whole-brain, data-driven analysis[EB/OL].[2017-06-20]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4475740/pdf/BMRI2015-495375.pdf. |
| [6] | 张乐乐, 赵小虎, 林起湘, 等. AD患者脑功能偏侧性改变的静息态fMRI研究[J]. 同济大学学报(医学版), 2016, 37(4): 60-64. (ZHANG L L, ZHAO X H, LIN Q X, et al. Study on resting fMRI of biopsy in patients with AD[J]. Journal of Tongji University (Medical Sciences), 2016, 37(4): 60-64.) |
| [7] | 张朦. 基于MRI的AD早期患者脑网络拓扑特性研究[D]. 北京: 北京理工大学, 2015. (ZHANG M. Study on brain network topological characteristics of AD patients based on MRI[D]. Beijing:Beijing University of Science and Technology, 2015.) http://cdmd.cnki.com.cn/Article/CDMD-10007-1015809830.htm |
| [8] | WANG K, LIANG M, WANG L, et al. Altered functional connectivity in early Alzheimer's disease:a resting-state fMRI study[J]. Human Brain Mapping, 2007, 28(10): 967-978. DOI:10.1002/(ISSN)1097-0193 |
| [9] | PLIS S M, SUI J, LANE T, et al. High-order interactions observed in multi-task intrinsic networks are dominant indicators of aberrant brain function in schizophrenia[J]. NeuroImage, 2014, 102: 35-48. DOI:10.1016/j.neuroimage.2013.07.041 |
| [10] | JIE B, WEE C Y, SHEN D, et al. Hyper-connectivity of functional networks for brain disease diagnosis[J]. Medical Image Analysis, 2016, 32: 84-100. DOI:10.1016/j.media.2016.03.003 |
| [11] | TEWARIE P, VAN DELLEN E, HILLEBRAND A, et al. The minimum spanning tree:an unbiased method for brain network analysis[J]. NeuroImage, 2015, 104: 177-188. DOI:10.1016/j.neuroimage.2014.10.015 |
| [12] | TZOURIO-MAZOYER N, LANDEAU B, PAPATHANASSIOU D, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain[J]. NeuroImage, 2002, 15(1): 273-289. DOI:10.1006/nimg.2001.0978 |
| [13] | RUBINOV M, SPORNS O. Complex network measures of brain connectivity:uses and interpretations[J]. NeuroImage, 2010, 52(3): 1059-1069. DOI:10.1016/j.neuroimage.2009.10.003 |
| [14] | LI X, CHANG L, ZHENG K, et al. Ranking weighted clustering coefficient in large dynamic graphs[J]. World Wide Web, 2017, 2015: 855-883. |
| [15] | WEE C Y, YAP P T, ZHANG D, et al. Identification of MCI individuals using structural and functional connectivity networks[J]. NeuroImage, 2012, 59(3): 2045-2056. DOI:10.1016/j.neuroimage.2011.10.015 |
| [16] | CHANG C C, LIN C J. LIBSVM:a library for support vector machines[J]. ACM Transactions on Intelligent Systems and Technology, 2011, 2(3): 27. |
| [17] | CHEN G, WARD B D, XIE C, et al. Classification of Alzheimer disease, mild cognitive impairment, and normal cognitive status with large-scale network analysis based on resting-state functional MR imaging[J]. Radiology, 2011, 259(1): 213-221. DOI:10.1148/radiol.10100734 |
| [18] | ROSA M J, PORTUGAL L, HAHN T, et al. Sparse network-based models for patient classification using fMRI[J]. NeuroImage, 2015, 105: 493-506. DOI:10.1016/j.neuroimage.2014.11.021 |
| [19] | WEE C Y, YANG S, YAP P T, et al. Sparse temporally dynamic resting-state functional connectivity networks for early MCI identification[J]. Brain Imaging and Behavior, 2013, 10(2): 342-356. |
| [20] | AGGLETON J P, PRALUS A, NELSON A J D, et al. Thalamic pathology and memory loss in early Alzheimer's disease:moving the focus from the medial temporal lobe to Papez circuit[J]. Brain, 2016, 139(7): 1877-1890. DOI:10.1093/brain/aww083 |
| [21] | ZAMBONI G, WILCOCK G K, DOUAUD G, et al. Resting functional connectivity reveals residual functional activity in Alzheimer's disease[J]. Biological Psychiatry, 2013, 74(5): 375-383. DOI:10.1016/j.biopsych.2013.04.015 |
| [22] | GRADY C L, FUREY M L, PIETRINI P, et al. Altered brain functional connectivity and impaired short-term memory in Alzheimer's disease[J]. Brain, 2001, 124(4): 739-756. DOI:10.1093/brain/124.4.739 |
| [23] | SUN Y, YIN Q, FANG R, et al. Disrupted functional brain connectivity and its association to structural connectivity in amnestic mild cognitive impairment and Alzheimer's disease[J]. PloS One, 2014, 9(5): e96505. DOI:10.1371/journal.pone.0096505 |
| [24] | MAXIM V, SENDUR L, FADILI J, et al. Fractional Gaussian noise, functional MRI and Alzheimer's disease[J]. NeuroImage, 2005, 25(1): 141-158. DOI:10.1016/j.neuroimage.2004.10.044 |
| [25] | 奉国和. SVM分类核函数及参数选择比较[J]. 计算机工程与应用, 2011, 47(3): 123-124. (FENG G H. SVM classification kernel function and parameter selection comparison[J]. Computer Engineering and Applications, 2011, 47(3): 123-124.) |




