骨质疏松症是中老年人最常见的骨骼疾病,典型临床表现为疼痛和骨折。临床上应注意与其他骨骼疾病相鉴别。对于规律抗骨质疏松治疗但治疗效果不佳时,需进一步排查继发性因素和其他并发症的可能,尽早正确诊断,并给予针对性治疗。
病例摘要患者,男,72岁,因“反复双下肢水肿15年,腰背痛10年,加重半个月”于2015年2月3日入四川大学华西医院。2000年患者无明显诱因出现双下肢水肿,伴泡沫尿,当地医院考虑“肾病综合征”,长期予以强的松治疗,减量或停药后病情易反复。2005年患者无明显诱因出现腰背痛,未予以重视。2009年患者双下肢水肿加重,就诊于四川大学华西医院,行肾脏穿刺提示肾小球呈系膜轻~中度增生伴缺血改变,诊断为肾病综合征,继续予强的松治疗,双下肢水肿逐渐减轻。2011年1月患者无明显诱因出现腰背痛加重,胸腰椎MRI示T6、T11、L1、L2、L4椎体压缩呈楔形变,其中,T11椎体为新发骨折;骨密度双能X线吸收检测仪 (dual energy X-ray absorptiometry,DXA) 示股骨颈、全髋骨密度值分别为0.679、0.768 g/cm2;诊断“重度骨质疏松症伴多发椎体压缩性骨折”,输注唑来膦酸5 mg、行T11椎体成形术后,腰背痛明显缓解。2011年11月患者腰背痛再次加重,胸椎MRI提示T10椎体新发骨折,输注唑来膦酸5 mg,行T10、L1、L2椎体成形术后疼痛明显缓解。2012-2014年患者坚持每年输注1次唑来膦酸5 mg,腰背痛逐渐减轻。入院前半个月患者起床时突发腰背痛加重伴明显活动受限,再次就诊于四川大学华西医院。自患病以来,精神、食欲、睡眠可,偶有便秘,夜尿约2~4次/晚,体质量无明显降低,身高较历史身高降低约13 cm。4年前诊断糖尿病,坚持生活方式干预,血糖控制可。个人史、家族史等无特殊。入院时查体:生命体征平稳,身高157 cm,体质量62 kg,轮椅推入,神志清楚,痛苦面容,牙齿无脱落,心肺腹查体未见明显异常。脊柱胸椎段稍后凸,胸腰椎棘突压痛、叩痛明显。双小腿轻度凹陷性水肿。
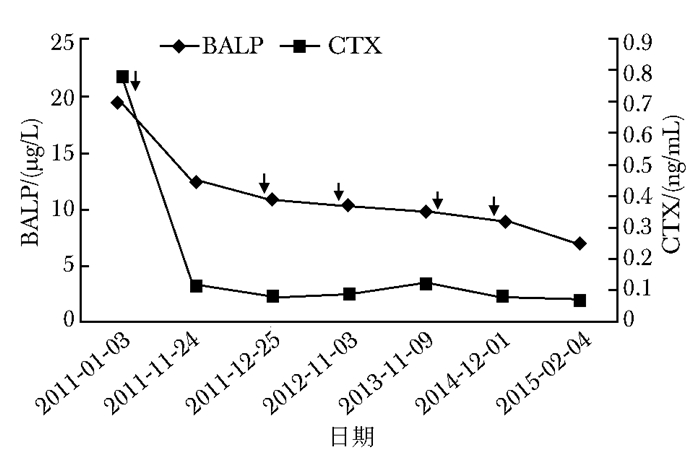
实验室检查血常规示白细胞 (white blood cell,WBC)5.66×109/L,红细胞 (red blood cell,RBC)2.63×1012/L,血红蛋白 (hemoglobin,HGB)90 g/L,红细胞平均体积 (mean corpuscular volume,MCV) 106.1 fL,细胞平均血红蛋白量 (mean corpuscular hemoglobin,MCH) 35.4 pg;尿常规:尿蛋白定性+++; 24 h尿蛋白定量6.60~7.93 g/24 h (参考值: < 0.15 g/24 h);粪常规、肝脏功能、肾脏功能、甲状腺功能正常。血钙1.86 mmol/L (参考值:2.1~2.7 mmol/L),血磷1.17 mmol/L (参考值:0.81~1.45 mmol/L),甲状旁腺素3.94 pmol/L (参考值:1.60~6.90 pmol/L),25-羟基维生素D 51.18 nmol/L (参考值:47.7~144 nmol/L),骨转换指标见图 1。
|
| 图 1 输注唑来膦酸前后BALP和CTX变化曲线 Figure 1 Changes of BALP and CTX levels at pre-and post-infusion of zoledronic acid BALP:骨特异性碱性磷酸酶 (参考范围:11.4~24.6 μg/L);CTX:Ⅰ型胶原羧基末端肽 (0.3~0.584 ng/mL);↓代表分别于2011-01-05、2011-12-01、2012-11-01、2013-11-13及2014-11-28静脉输注唑来膦酸5 mg |
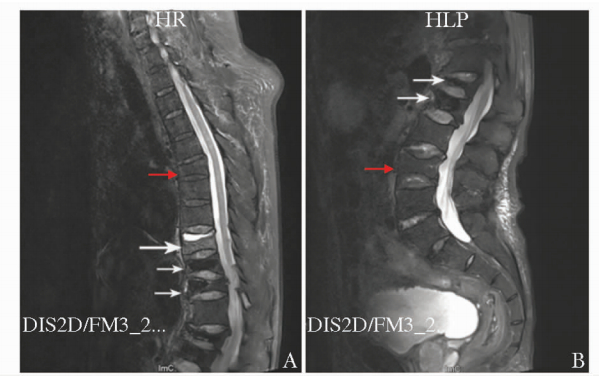
复习患者既往资料,自2009年起,监测患者血红蛋白自137 g/L逐渐降至90 g/L,白蛋白自35.7 g/L逐渐降至22 g/L (参考值:40~55 g/L),碱性磷酸酶则自91 IU/L逐渐降至44 IU/L (参考值:50~160 IU/L)。经白蛋白水平校正后,血钙2.22~2.24 mmol/L, 位于正常范围内;球蛋白及血磷始终处于正常范围且变化不明显。血轻链KAP/LAM比值增高 (表 1),多次血清蛋白电泳可见M蛋白,免疫固定电泳示M蛋白为IgG κ型 (图 2),骨密度值变化不明显 (表 2)。曾多次建议患者行骨髓穿刺均被拒绝。血液内科会诊考虑轻链增高与长期使用糖皮质激素相关,建议观察随访,患者未遵医嘱就诊。此次入院,患者同意行骨髓穿刺,检查结果提示骨髓造血细胞增生明显低下,流式细胞分析查见1.2%克隆性浆细胞。血液内科会诊考虑存在多发性骨髓瘤,建议复查骨髓涂片细胞学及流式细胞学检查并转血液科继续治疗,但患者拒绝。该例患者存在明显腰背痛伴活动受限,行胸腰椎MRI提示T6、T9,T10、T11、L1、L2、L4压缩呈楔形变,T9椎体内见条状长T1稍长T2信号改变 (图 3)。考虑T9为新发骨折,行椎体成形术,术后疼痛明显缓解,活动能力明显改善。因3个月前患者曾输注唑来膦酸5 mg,抗骨质疏松药物治疗方面仅需继续补充钙剂和维生素D。
| 时间 | 血KAP轻链 (g/L) | 血LAM轻链 (g/L) | 血KAP/LAM比值 | 尿KAP轻链 (g/L) | 尿LAM轻链 (g/L) |
| 2009-03 | - | - | - | 0.576 | 0.330 |
| 2011-01 | 11 | 2.03 | 5.42 | < 0.0185 | < 0.05 |
| 2011-11 | 11 | 1.72 | 6.4 | < 0.0185 | < 0.05 |
| 2012-10 | 13.1 | 1.83 | 7.16 | < 0.0185 | < 0.05 |
| 2013-11 | 10.7 | 1.55 | 6.90 | - | - |
| 2014-07 | 10.9 | 1.54 | 7.08 | - | - |
| 2014-11 | 10.5 | 1.56 | 6.73 | - | - |
| 2015-02 | 9.42 | 1.83 | 5.15 | - | - |
| 参考范围 | 6.98~13 | 3.8~6.5 | 1.5~2.56 | < 0.02 | < 0.05 |

|
| 图 2 免疫固定电泳结果 Figure 2 Laboratory results of immunofixation electrophoresis G:IgG;A:IgA;M:IgM;κ:血KAP轻链;λ:血LAM轻链 |
| 时间 | 股骨颈 | 全髋 | |||||
| 绝对值 (g/cm2) | T值 | 较上一次骨密度改变 (%) | 绝对值 (g/cm2) | T值 | 较上一次骨密度改变 (%) | ||
| 2011-01 | 0.679 | - | - | 0.768 | - | - | |
| 2011-11 | 0.683 | -2.3 | 0.6 | 0.789 | -1.6 | 2.7 | |
| 2012-11 | 0.695 | -2.2 | 1.8 | 0.788 | -1.6 | -0.1 | |
| 2014-11 | 0.713 | -2.0 | 2.5 | 0.780 | -1.6 | -1.0 | |
| L1、L2、L4均有压缩性骨折,其中L1、L2为椎体成形术后改变,L3骨质增生明显,均未纳入分析;2013年被标记的全髋感兴趣区与其他年份大小及形状不一致,故此年股骨颈、全髋骨密度值不纳入比较 | |||||||
|
| 图 3 胸椎 (A) 和腰椎 (B) MRI Figure 3 MRI of thoracic vertebra (A) and lumbar vertebra (B) 白色长箭头:考虑T9椎体新发骨折;白色短箭头:T10、T11、L1、L2压缩性骨折行椎体成形术后改变;红色箭头:T6、L4陈旧性压缩性骨折 |
本例患者为老年男性,慢性病程,长期使用糖皮质激素,临床表现为腰背痛及活动受限,胸腰椎MRI可见多发椎体压缩性骨折,DXA检查提示骨密度显著降低,老年性并发糖皮质激素相关性骨质疏松症诊断明确。本例诊治的关键在于探究规律抗骨质疏松治疗过程中反复发生骨折的原因。
本例患者病程中一个重要特点是反复骨折,考虑系以下因素共同作用所致。文献报道50岁以上男性中约20%至少会发生一次骨质疏松性骨折,使用唑来膦酸2年,椎体骨折风险可降低70%左右[1]。该例患者存在肾病综合征,疾病本身及其治疗药物糖皮质激素均可降低骨量、增加跌倒和骨折的风险[2-5]。对于糖皮质激素相关性骨质疏松症 (glucocorticoid-induced osteoporosis,GIOP),唑来膦酸使用1年可降低椎体骨折风险约40%[6]。同时,研究显示2型糖尿病患者髋部、椎体骨折风险明显增高[7-8]。以上因素综合效应使患者频发骨折。该患者规律抗骨质疏松治疗后疼痛明显缓解,2012-2014年间未新发骨折,且骨转换指标受到明显抑制 (表 1),这表明唑来膦酸抗骨质疏松的疗效比较确切。但即便在此种情况下,2015年再次发生椎体骨折,提示可能存在其他影响抗骨质疏松疗效的因素。本例患者日常重视补充钙剂及维生素D,25OHD水平未见明显低下,否认高钠饮食及胃肠道疾病史,故不考虑钙剂、维生素D摄入不足或吸收障碍。否认抑郁症、失眠和相关药物史。无风湿免疫性疾病的相关表现且实验室检查不支持。患者平素活动能力尚可,查体未见明显神经肌肉系统异常,故此类疾病可能性不大。此外,仍需明确有无恶性肿瘤可能。结合患者存在骨骼损害、贫血,多次血清学检查发现单克隆球蛋白 (M蛋白),骨髓穿刺发现克隆性浆细胞,考虑存在多发性骨髓瘤 (mulitiple myoloma,MM)[9]。
MM是浆细胞异常增生的恶性肿瘤,多发生于老年,以男性为主。主要表现为骨骼受累、肾功损害及贫血等。实验室检查可见血钙升高,碱性磷酸酶正常或降低,血尿轻链增高或比值增加,血清蛋白电泳、免疫固定电泳提示M蛋白,伴蛋白尿、血清尿素氮和肌酐增高,血红蛋白降低等,影像学检查可见骨质疏松、骨质破坏或骨折,骨穿查见克隆性浆细胞。MM所致骨病的病理机制主要与骨保护素 (osteoprotegerin,OPG) 对核因子κB (RANK) 结合核因子κB受体活化因子配体 (RANKL) 的抑制作用减弱有关,破骨细胞前体上调、增生和融合为成熟的破骨细胞数目增加,活性增强,导致骨吸收加快,进而出现骨量减低、骨折风险增高。MM分泌的单克隆免疫球蛋白轻链对肾脏近曲小管有直接毒性作用,可导致肾功能不全,进而可减少促红细胞生成素产生;此外,克隆性浆细胞可抑制红系增生,结合红细胞自身寿命缩短,可出现贫血。该例患者此次就诊伴有新发骨折、尿蛋白增加及贫血加重,由于其病史长达15年,尚不明确肾病综合征、骨质疏松症和贫血是否由MM所致,但MM的存在无疑会加重病情的进展。
对于MM所致骨骼损害,二膦酸盐除能抑制破骨细胞活性、促进其凋亡外,还可抑制恶性细胞克隆性增生及侵袭,促进其凋亡[10]。研究显示氯膦酸盐[11]、帕米膦酸钠[12]、伊班膦酸钠[13]和唑来膦酸 (4 mg,每3~4周1次)[14]均能降低MM患者骨折风险。因此,推测该例患者新骨折的出现可能是因为唑来膦酸 (5 mg,每年1次) 虽然可以部分缓解由MM所致的骨骼损害,但原发病灶尚未去除,且MM对骨骼的破坏随着时间愈发加重。除了用于MM外,唑来膦酸同样可治疗该患者的骨质疏松症。综合考虑MM本身、糖皮质激素等导致骨骼损害的因素持续存在,且目前骨折风险较高,暂不考虑停用唑来膦酸,必要时可换用其他类抗骨质疏松药物[15]。
另外需要注意的是,基于该患者已出现MM的终末器官损害 (贫血、骨质疏松、骨折),需要立即进行化学药物治疗。同时,新发椎体骨折所致的明显疼痛和活动障碍,会严重降低患者的生活质量,也需积极干预。在此情况下,有行椎体成形术的指征。患者虽然高龄并有多种基础疾病,手术风险较高,但该手术所致的创伤小、术后能迅速且大幅度缓解疼痛,显著提高活动能力,有效避免了因骨折卧床所导致的肺炎、褥疮等严重并发症的发生,术后效果也获得了患者及家属的认同。
综上所述,该患者在规律抗骨质疏松治疗中仍反复骨折,进一步的检查提示并发多发性骨髓瘤。该例患者的诊疗经过提示,当规范治疗骨质疏松但疗效较差时,应及时鉴别是否伴随或新出现其他导致骨骼损害的危险因素,并加以有效处理,以免病情进展,导致不良的后果。
| [1] | Boonen S, Reginster JY, Kaufman JM, et al. Fracture risk and zoledronic acid therapy in men with osteoporosis[J]. New Engl J Med, 2012, 367 : 1714–1723. |
| [2] | Elder GJ. Nephrotic syndrome: Don't forget the bones!(Editorial)[J]. Nephrology, 2008, 13 : 43–44. DOI:10.1111/nep.2008.13.issue-1 |
| [3] | Canalis E, Delany AM. Mechanisms of glucocorticoid action in bone[J]. Ann NY Acad Sci, 2002, 966 : 73–81. DOI:10.1111/nyas.2002.966.issue-1 |
| [4] | Natsui K, Tanaka K, Suda M, et al. High-dose glucocorticoid treatment induces rapid loss of trabecular bone mineral density and lean body mass[J]. Osteoporosis Int, 2006, 17 : 105–108. DOI:10.1007/s00198-005-1923-3 |
| [5] | Wallach S, Cohen S, Reid DM, et al. Effects of risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy[J]. Calcified Tissue Int, 2000, 67 : 277–285. DOI:10.1007/s002230001146 |
| [6] | Reid DM, Devogelaer JP, Saag K, et al. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial[J]. Lancet, 2009, 373 : 1253–1263. |
| [7] | Janghorbani M, Van Dam RM, Willett WC, et al. Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture[J]. Am J Epidemiol, 2007, 166 : 495–505. |
| [8] | Yamamoto M, Yamaguchi T, Yamauchi M, et al. Diabetic patients have an increased risk of vertebral fractures independent of BMD or diabetic complications[J]. J Bone Miner Res, 2009, 24 : 702–709. DOI:10.1359/jbmr.081207 |
| [9] | Bird JM, Owen RG, D'Sa S, et al. Guidelines for the diagnosis and management of multiple myeloma 2011[J]. Br J Haematol, 2011, 154 : 32–75. DOI:10.1111/bjh.2011.154.issue-1 |
| [10] | Ashcroft AJ, Davies FE, Morgan GJ. Aetiology of bone disease and the role of bisphosphonates in multiple myeloma[J]. Lancet Oncol, 2003, 4 : 284–292. |
| [11] | McCloskey EV, MacLennan ICM, Drayson MT, et al. A randomized trial of the effect of clodronate on skeletal morbidity in multiple myeloma[J]. Br J Haematol, 1998, 100 : 317–325. |
| [12] | Berenson JR, Lichtenstein A, Porter L, et al. Efficacy of pamidronate in reducing skeletal events in patients with advanced multiple myeloma[J]. New Engl J Med, 1996, 334 : 488–493. DOI:10.1056/NEJM199602223340802 |
| [13] | Terpos E, Viniou N, De La Fuente J, et al. Pamidronate is superior to ibandronate in decreasing bone resorption, interleukin-6 and β2-microglobulin in multiple myeloma[J]. Eur J Haematol, 2003, 70 : 34–42. |
| [14] | Rosen LS, Gordon D, Kaminski M, et al. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma: a phase Ⅲ, double-blind, comparative trial[J]. Cancer J, 2000, 7 : 377–387. |
| [15] | Adler RA, Fuleihan GEH, Bauer DC, et al. Managing osteoporosis in patients on long‐term bisphosphonate treatment: report of a task force of the American society for bone and mineral research[J]. J Bone Miner Res, 2016, 31 : 16–35. |
| (收稿日期:2016-04-19) |

