骨髓脂肪是一种特殊的脂肪组织,骨髓脂肪的特殊性表现在其起源于白色脂肪组织(white adipose tisse, WAT),却与棕色脂肪组织(brown adipose tissue, BAT)的特点一致。骨髓脂肪来源于骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)的成脂作用,即由BMMSCs分化成脂肪细胞,经历细胞成熟的各个阶段(包括母细胞、前体细胞、不成熟细胞)最终分化为成熟脂肪细胞的过程[1-3]。骨髓脂肪是骨髓微环境的重要组成部分,影响着BMMSCs的成骨作用。髓内脂肪细胞和成骨细胞两者表现形式一样,因为它们都由BMMSCs分化而来,在某些条件下两者可以出现横向分化,即存在彼此转换,并且出现两种细胞分化互相作用,互相抑制的状态[4]。
我国地域辽阔,各地区气候、温度、日晒等差异较大,北方地区寒冷季节长,研究表明,成人骨骼肌在寒冷环境中会产生寒颤,长时间暴露时产生寒颤的代谢强度大概可以达到最大耗氧量的40%[5]。实验证实, 温度与脂肪代谢之间相关性明显, 环境温度的降低会影响脂肪的合成和分解代谢。有研究表明北方地区骨质疏松症的患病率为11.1%,低于南方骨质疏松症患病率28.5%[6],这种南北骨质疏松症患病率的差别除与饮食、活动、民族有关外,环境因素尤其是南北温度的差别,值得引起重视,本研究分析冷刺激对骨髓脂肪组织的影响,为进一步研究环境温度对于骨质疏松症的影响提供切实的数据。
材料与方法 实验动物选取36只健康6~8周龄雄性C57BL/6小鼠,采用数字表法随机分为2组:常温对照组和寒冷刺激组。对照组在室温20 ℃左右饲养,寒冷刺激组在4 ℃左右饲养,每组再根据饲养时间7、14、21 d分为3组,共6组。顺应条件变化先饲养7 d,各组小鼠均为标准饮食。分离双侧股骨、胫骨,小心分离股骨、胫骨旁边连着的肌肉等软组织,股骨浸泡于4%多聚甲醛溶液中,用于免疫组化、免疫荧光检测。
HE染色小鼠处死后取小鼠股骨组织,将其使用蔗糖脱水后用OTC包埋剂包埋并使用冷冻切片机切成10 μm厚的冰冻切片,在室温下自然风干后进行苏木素和伊红染色后封片于显微镜下观察并拍照。(DP73, Olympus, Tokyo, Japan)
cAMP和甘油测定寒冷刺激后,小鼠处死后取骨髓进行cAMP和甘油测定,分别使用环磷酸腺苷(cyclic adenosine monophosphate,cAMP)检测试剂盒(USCN Life science, wuhan, China)甘油测定试剂盒(Sigma-Aldrich,st, USA)。
免疫组织化学检测取小鼠股骨进行脱水、透蜡、包埋后使用切片机切成5 μm的薄片,然后放入抗原修复液中进行抗原修复,过氧化氢孵育15 min,经过山羊血清封闭、一抗孵育、二抗孵育和辣根酶标记后加入100 μ LDAB显色试剂进行显色,待颜色刚刚变深时迅速置于水中终止反应。然后切片浸入苏木素中复染,最后脱水、透明、封片。于显微镜下观察染色效果并在400倍镜下拍照。
统计学方法用SPSS17.0软件统计学分析。计量资料表示为均数±标准差(x±s),运用多因素方差分析,组间两两比较采用LSD检验,以P<0.05为差异有统计学意义。
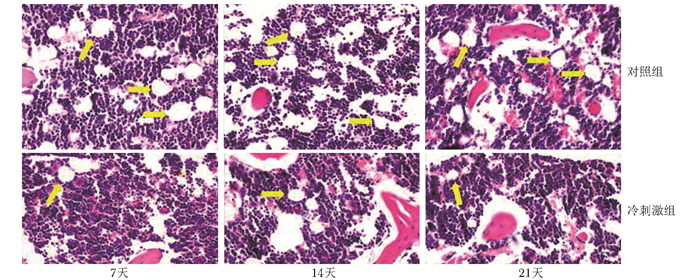
结果 冷刺激对骨髓脂肪组织的作用HE染色观察骨髓脂肪细胞数目变化,可见寒冷刺激组中骨髓脂肪细胞数目较正常组相比略有减少,并且随着寒冷刺激时间的延长,数目减少越明显(图 1)。
|
| 图 1 冷刺激组与对照组小鼠骨髓脂肪组织的比较(HE,400×) Figure 1 Micrographs of bone marrow adipose tissue sections in the control group and the cold exposure group(HE, 400×) 箭头示细胞减少 |
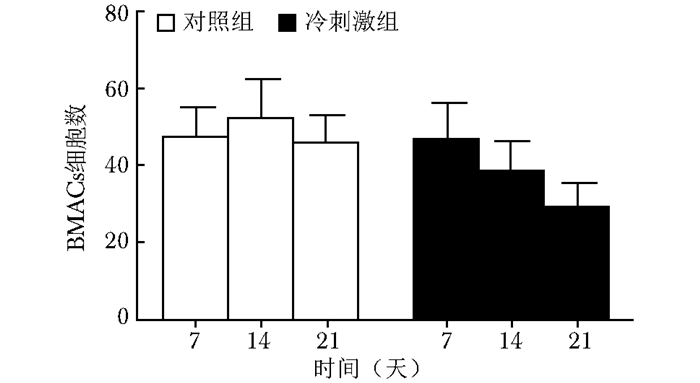
HE染色后骨髓脂肪组织图片经两名具有足够阅片经历的病理科医师在光镜下计数脂肪细胞数。本实验骨髓脂肪细胞数为半定量数据, 寒冷刺激组中骨髓脂肪细胞数目较正常组相比略有减少,并且随着寒冷刺激时间的延长,数目减少越明显(F=7.253,P=0.020)(图 2)。
|
| 图 2 冷刺激对骨髓脂肪细胞数的影响 Figure 2 Effects of cold exposure on bone marrow adipose cell numbers BMMSCs:骨髓间充质干细胞 |
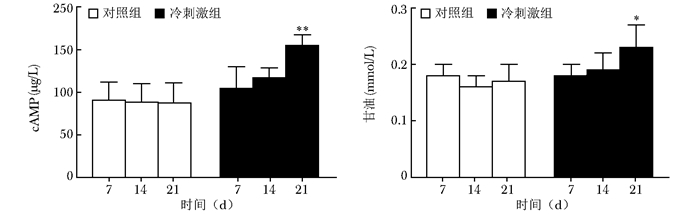
相比于对照组冷刺激可以提高骨髓脂肪组织中的cAMP水平且差异有统计学意义(F=23.579,P=0.000)。对比于对照组,冷刺激14 d骨髓脂肪组织中cAMP值有所上升(P=0.047),冷刺激21 d时cAMP值对比于常温对照组异常增高(P=0.008)。冷刺激能小幅度提高骨髓脂肪组织脂降解产物甘油的水平(F=10.086,P=0.003),冷刺激21 d后,骨髓脂肪组织中甘油的水平相比于对照组异常增高(P=0.015)(表 1,图 3)。
| 分组 | 时间(d) | cAMP(ng/L) | 甘油(mmol/L) |
| 对照组 | 7 | 90.25±20.71 | 0.18±0.02 |
| 14 | 88.11±21.75 | 0.16±0.02 | |
| 21 | 87.23±23.28 | 0.17±0.03 | |
| 冷刺激组 | 7 | 104.36±25.52 | 0.18±0.02 |
| 14 | 116.96±11.48 | 0.19±0.03 | |
| 21 | 154.30±12.83 * | 0.23±0.04 * | |
| cAMP:环磷酸腺苷;与对照组21 d比较,*P<0.05 | |||
|
| 图 3 冷刺激组与对照组骨髓脂肪组织的脂降解的cAMP和甘油水平比较(x±s,n=6) Figure 3 Effects of cold exposure on cAMP and glycerol levels(x±s, n=6) cAMP:环磷酸腺苷;与对照组比较,*P<0.05, **P<0.01 |
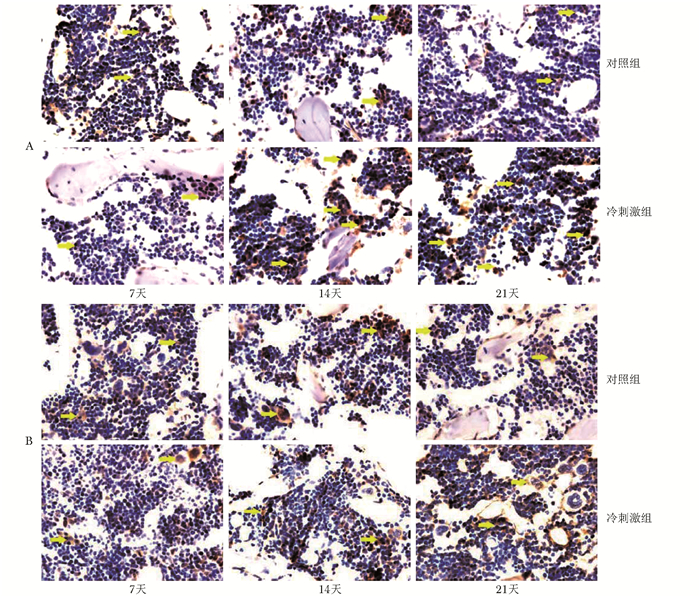
IHC最终通过DAB显色,即呈现棕褐色为阳性。与对照组相比较,Runx2在冷刺激组骨髓基质细胞胞质中呈阳性表达(图 4A)而PPARγ表达在对照组与冷刺激组间阳性表达不明显(图 4B)。
|
| 图 4 冷刺激后Runx2和PPARγ的表达(免疫组织化学检测,400×) Figure 4 Effects of cold exposure on Runx2 and PPARγ levels(Immunohistochemistry, 400×) A:Runt相关转录因子2(Runx2);B:过氧化物酶体增生物激活受体γ(PPARγ);箭头示阳性表达 |
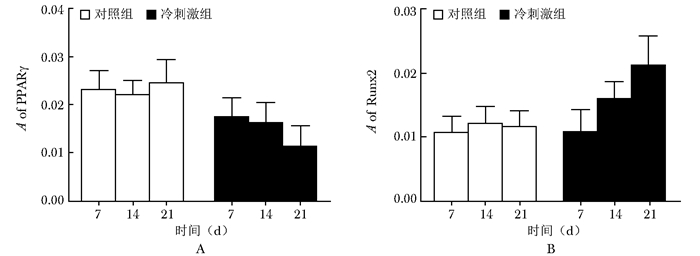
本实验应用Image-Pro Plus软件处理免疫组织化学检测图片得到吸光度值,Runx2在对照组中吸光度值较低,随着寒冷刺激时间延长,值有所增加,差异有统计学意义(F=9.177,P=0.010,图 5B)。而PPARγ却随着寒冷刺激时间的延长,吸光度值有所降低,对照组与冷刺激组比较,差异无统计学意义(F=0.019,P=0.890,图 5A)。
|
| 图 5 PPARγ和Runx2吸光度值(x±s,n=6) Figure 5 Asorbtance value of PPAR gamma and Runx2(x±s, n=6) A:过氧化物酶体增生物激活受体γ(PPARγ);B:Runt相关转录因子2(Runx2) |
骨髓脂肪具有WAT和BAT的表现型,但其标志物却为BAT。髓外脂肪增长关键体现在脂肪细胞体积的变大并不伴有数目的增长;但髓内脂肪的增长体现在体积增长的同时伴随数目增长。髓内脂肪又是骨髓微环境的重量级成员,但它的作用尚不完全明了。
已有研究表明冷刺激可以使白色脂肪组织向具有高代谢率的棕色脂肪样组织转型,而在温度较高的环境中又可以促进棕色脂肪组织向白色脂肪组织的转化[7-9]。但冷刺激对骨髓脂肪组织的的研究却未见报道。
本实验研究冷刺激对于骨髓脂肪的影响。400倍镜下观察骨髓脂肪细胞数目变化,可见寒冷刺激组中骨髓脂肪细胞数目较正常组相比略有减少,并且随着寒冷刺激时间的延长,数目减少越明显。本实验检测骨髓脂肪细胞数为半定量数据,所以未能定量观察冷刺激后骨髓脂肪细胞的体积、直径等的变化。
本实验检测到了冷刺激可以增加骨髓脂肪的脂解率,但是冷刺激引起骨髓脂肪的这种改变的具体原因有待进一步的研究。传统观点认为,脂降解是脂肪组织将TG降解为甘油和FFA的过程。在该过程中去甲肾上腺素(noradrenaline, NE)激活β-肾上腺素能受体,使乙酰环化酶产生的cAMP增加,进一步激活蛋白激酶A(protein kinase A, PKA)和激素敏感脂酶(hormone-sensitive triglyceride lipase, HSL),最终将甘油三酯逐步水解为甘油和FFA。本研究检测了cAMP和甘油这两个脂降解过程中的关键靶点。
本实验发现相比于对照组冷刺激可以提高骨髓脂肪组织中的cAMP水平且差异有统计学意义(F=23.579,P=0.000)。与对照组比较,冷刺激14 d骨髓脂肪组织中cAMP值有所上升(P=0.047),冷刺激21 d时cAMP值对比于常温对照组异常增高(P=0.008)。冷刺激能小幅度提高骨髓脂肪组织的脂降解产物甘油的水平(F=10.086,P=0.003),在冷刺激21 d后,骨髓脂肪组织中甘油的水平相比于对照组异常增高(P=0.015)。冷刺激加剧了骨髓脂肪组织的脂降解速率,影响了骨髓脂肪组织。冷刺激是否可以通过骨髓内脂肪组织而影响骨代谢,有待进一步研究。
为了进一步探索冷刺激对于骨髓脂肪组织影响,本研究用免疫组织化学检测各组小鼠股骨中Runx2和PPARγ的表达。以往研究已经证实,成骨转录因子Runx2是成骨细胞增生成熟等阶段中重要的调节因子,在生骨阶段中扮演着关键的角色。现在的研究用Runx2衡量BMMSCs的成骨能力[10]。成脂转录因子PPARγ是生成成熟脂肪细胞的过程中必不可少的细胞因子,Runx2和PPARγ表达的强弱可能会决定BMMSCs最终分化为成骨细胞还是脂肪细胞。因此,以上两个调控因子是调控成骨分化和成脂分化的关键分子。有通过PPARγ基因敲除的小鼠模型发现,成骨细胞分化、增生能力明显增强,骨代谢增强,脂肪细胞分化、增生能力相对减弱。并且提出在此过程中PPARγ可能直接调节成骨细胞分化。通过实验还提出,过量表达PPARγ的成骨细胞分化、增生能力减弱,同时还出现转化为脂肪细胞的横向分化。
本实验中,与常温对照组比较而言,Runx2在冷刺激组骨髓基质细胞胞质中呈阳性表达,而PPARγ在对照组与冷刺激组间阳性表达均不显著。由以上实验数据证明,冷刺激对于骨髓基质细胞的成脂分化作用不明显,结合上面的实验结果,冷刺激使骨髓脂肪细胞数目相对减少,笔者推测冷刺激对于骨髓脂肪组织起抑制作用,而且冷刺激使骨髓基质细胞Runx2的表达增加,促进了骨髓基质细胞的成骨分化,打破了成脂分化和成骨分化的平衡,此消彼长,可能因此抑制了其向脂肪细胞的转化。这种变化也许与冷刺激对于SNS的作用相关,继而影响到成骨细胞表面的β2肾上腺素能受体,通过RANKL-RANK-OPG信号通路,最后引起骨代谢的变化。还有一种解释是冷刺激引起机体脂肪因子和炎性反应因子的释放,再由这些功能性因子引起机体骨代谢和脂代谢的变化。但是对于冷刺激是先影响了脂代谢,通过脂代谢的变化继而导致了骨代谢的改变还是通过骨代谢的改变影响了脂代谢的转变,又或是冷刺激同时对两种代谢途径都产生作用,需要进一步研究。
| [1] | 康鹏德, 裴福兴, 杨静. 骨髓脂肪细胞向成骨细胞的转分化[J]. 中国组织工程研究与临床康复, 2011, 15: 17–22. DOI:10.3969/j.issn.1673-8225.2011.01.004 |
| [2] | Kim WK, Meliton V, Bourquard N. Hedgehog signaling and osteogenicdifferenti ation in multipotent bone marrow stromal cells are inhibited by oxidative stress[J]. J Cell Biochem, 2010, 111: 1199–1209. DOI:10.1002/jcb.22846 |
| [3] | Watanabe K, Ikeda K. Osteoblast differentiation and bone formation[J]. Nihon Rin-sho, 2009, 67: 879–886. |
| [4] | 刘革修, 陈小宇, 祝爱珍. 脂肪细胞分化机制与骨髓造血微环境调控[J]. 暨南大学学报, 2012, 32: 116–120. DOI:10.3969/j.issn.1000-9965.2012.02.002 |
| [5] | Eyolfson DA, Tikuisis P, Xu X, et al. Measurement and prediction of peakshiveringintensity in humans[J]. Eur J ApplPhysiol, 2001, 84: 100–106. |
| [6] | 韩亚军, 帖小佳, 伊力哈木托合提. 中国中老年人骨质疏松症患病率的Meta分析[J]. 中国组织工程研究, 2014, 18: 1129–1134. DOI:10.3969/j.issn.2095-4344.2014.07.024 |
| [7] | Beranger GE, Karbiener M, Barquissau V. In vitro brown and "brite/" "beige" adi-pogenesis:Human cellular models and molecular aspects[J]. Biochim Biophy Sica Acta, 2012, 1831: 905–914. |
| [8] | Walden TB, Hansen IR, Timmons JA. Nonrecruited molecular signatures of brown, "brite, " and white adipose tissues[J]. Am J Physiol Endocrinol Metab, 2012, 302: E19–E31. DOI:10.1152/ajpendo.00249.2011 |
| [9] | Cannon B, Nedergaard J. Brown adipose tissue:function and physiological signi-ficance[J]. Physiol Rev, 2004, 84: 277–359. DOI:10.1152/physrev.00015.2003 |
| [10] | 罗依, 余勤. 低温冻存对成人骨髓间充质干细胞生物学特性的影响[J]. 中国病理生理杂志, 2006, 22: 384–387. DOI:10.3321/j.issn:1000-4718.2006.02.042 |
| (收稿日期:2017-01-17) |

