凝块石是以凝块组构为内部特征的微生物碳酸盐岩建隆, 是一种不同于具纹层构造的叠层石的重要微生物岩类型, 它们是微生物与环境相互作用的产物(Aitken, 1967;Kennard and James, 1986;Burne and Moore, 1987;杜汝霖, 1992;Kah and Grotzinger, 1992;曹瑞骥等, 2006;梅冥相, 2007;陈金勇等, 2014)。作为生物沉积构造, 一方面, 这些微生物岩的特征能够反映环境条件的变化, 如水动力条件、温度、碳酸盐饱和度以及缺氧程度等方面的信息(Riding and Liang, 2005;Woods and Baud, 2008;郭华等, 2010;Kershaw et al., 2012;Mata and Bottjer, 2012);另一方面, 微生物岩在地球早期历史于浅海环境大量发育, 记录了地球上最早的生态系统(Harwood and Sumner, 2011)。其中, 约2.5 Ga以前的叠层石就代表了一种原始的生命形式, 是所知的地球上最老生命的宏观证据(Awramik, 1992);同时, 有学者认为凝块石可能记录了真核生物的出现(Feldmann and McKenzie, 1998)。
自从凝块石以其内部“凝块(clot)”的结构特征命名以来(Aitken, 1967), 有关凝块石的报道、研究持续不断。凝块石最早的地质记录可追溯到古元古代(1.92 Ga)(Kah and Grotzinger, 1992), 是地球上最早的生物沉积生态系统之一。凝块石在岩石中的分布记录并不均匀, 其主要产出于寒武系和下奥陶统(Kennard and James, 1986;孔金平等, 1998;Riding, 2000;陈金勇等, 2014)。尽管前寒武的凝块石也有报道, 但仅有极少数可确定(Aitken and Narbonne, 1989;Kah and Grotzinger, 1992;Grotzinger et al., 2000, 2005;Turner et al., 2000;Tang et al., 2013), 其余大部分凝块石在时间或辨别上都还存在争议(如Walter and Heys, 1985;Kennard and James, 1986)。
与近年来在叠层石中发现的多种细菌群落作为其微生物成因直接证据, 进而提出的微生物与环境相互作用的成因理论相比(Arp et al., 2010;Berelson et al., 2011), 除了在个别显生宙的凝块结构中有球状细菌发现外(Monty, 1976;Soudry and Weissbrod, 1995), 绝大多数报道的凝块石中缺乏细菌群落的证据。尤其是对于前寒武的那些古老的凝块石, 极少在其中发现有细菌的保存, 故有人提出了前寒武纪的凝块石很可能是海相碳酸盐无机沉淀的结果(Kah and Grotzinger, 1992)。
我们所报道的凝块石产于华北地台中元古代高于庄组(1.60~1.53 Ga), 通过对其微观—超微结构的观察研究, 借助FESEM及EDS技术来鉴定中元古代岩石中生物构造的残余, 了解凝块石的形成过程, 从而更深刻地认识微生物与环境的相互作用。
1 地质背景与地层特征华北地台中元古界形成于Columbia超大陆裂解到Rodina超大陆汇聚的全球构造背景下, 是发育于燕山地区古老变质岩系之上的一套盖层性质的沉积地层(McMenamin and McMenamin, 1990;Hoffman, 1991;Pisarevsky and Natapov, 2003;Zhao et al., 2002, 2004;Rogers and Santosh, 2009)。根据近年来不断取得的锆石U-Pb SHRIMP测年成果, 可对中新元古代的地层格架进行较为准确的年龄框定(图 1)(Li et al., 2013;Tang et al., 2013)。其中, 高于庄组顶、底界年龄分别大致确定为1.53 Ga和1.60 Ga, 下马岭组的顶、底界约确定为1.32 G和1.40 Ga(乔秀夫等, 2007b;高林志等, 2008a, 2009, 2010;Li et al., 2013; 图 1)。长龙山组的年龄不早于1.0 Ga(高林志等, 2009, 2010), 属新元古界。中元古界上部在华北地台大部分地区出现缺失, 位于长龙山组和下马岭组间的不整合代表了长达3亿年的地层间断。
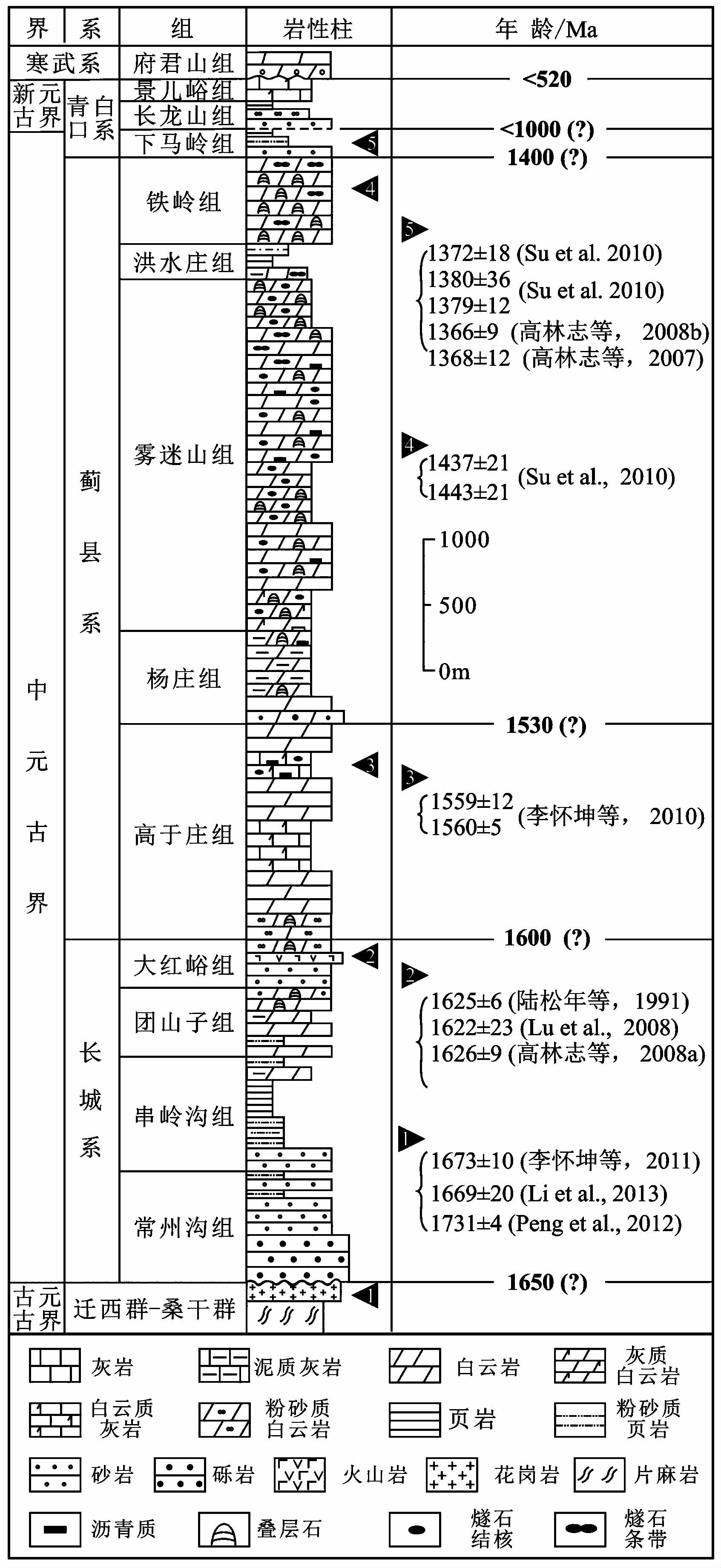
|
图1 华北地台元古宙地层序列及年龄限制(据Tang et al., 2013, 有修改) Fig.1 Stratigraphic subdivisions and zircon U-Pb age constraints of the Proterozoic succession in the North China platform(modified from Tang et al., 2013) |
本文研究的凝块石主要产于河北省承德市平泉县境内(图 2a), 大地构造位置属于华北克拉通北缘, 是中国中、上元古界发育较为完整的地区之一。在研究区, 平泉高于庄组剖面近千米厚, 以浅海碳酸盐岩为主, 可分为4个岩性段(图 2b):高于庄组一段底部为粉砂质泥页岩, 向上主要为灰黄色中—厚层泥晶白云岩, 可见纹层与硅质条带发育, 间夹少量砂质白云岩层, 以潮间—潮上带沉积为主;二段下部为浅灰白色中层—薄层状白云岩构成, 间夹有薄层状白云岩, 上部则由薄层与薄板状含纹层的白云岩构成, 泥质含量自下而上逐渐增多, 水体逐渐变深, 以潮下带上部—潮间带沉积为主;三段主要为薄层—薄板状微晶白云岩为主, 偶夹中层状白云岩及纹层白云岩, 层间可见粉砂质页岩, 整层沉积水体较深, 以内陆架—潮下带下部沉积为主;四段底部为碳酸盐岩结核(图 3a), 向上发育凝块石(凝块石层地貌呈陡坎; 图 3b)、纹理石、叠层石3种微生物碳酸盐岩, 其间夹有薄层状泥质白云岩, 该段上部出现多层竹叶状砾屑灰岩, 以潮下带上部—潮间带上部沉积为主。总体上, 高于庄组表现为海侵层序, 在高于庄组三段和四段底部沉积时海水达到了最深, 而后向上为逐渐变浅的趋势(图 2b)。
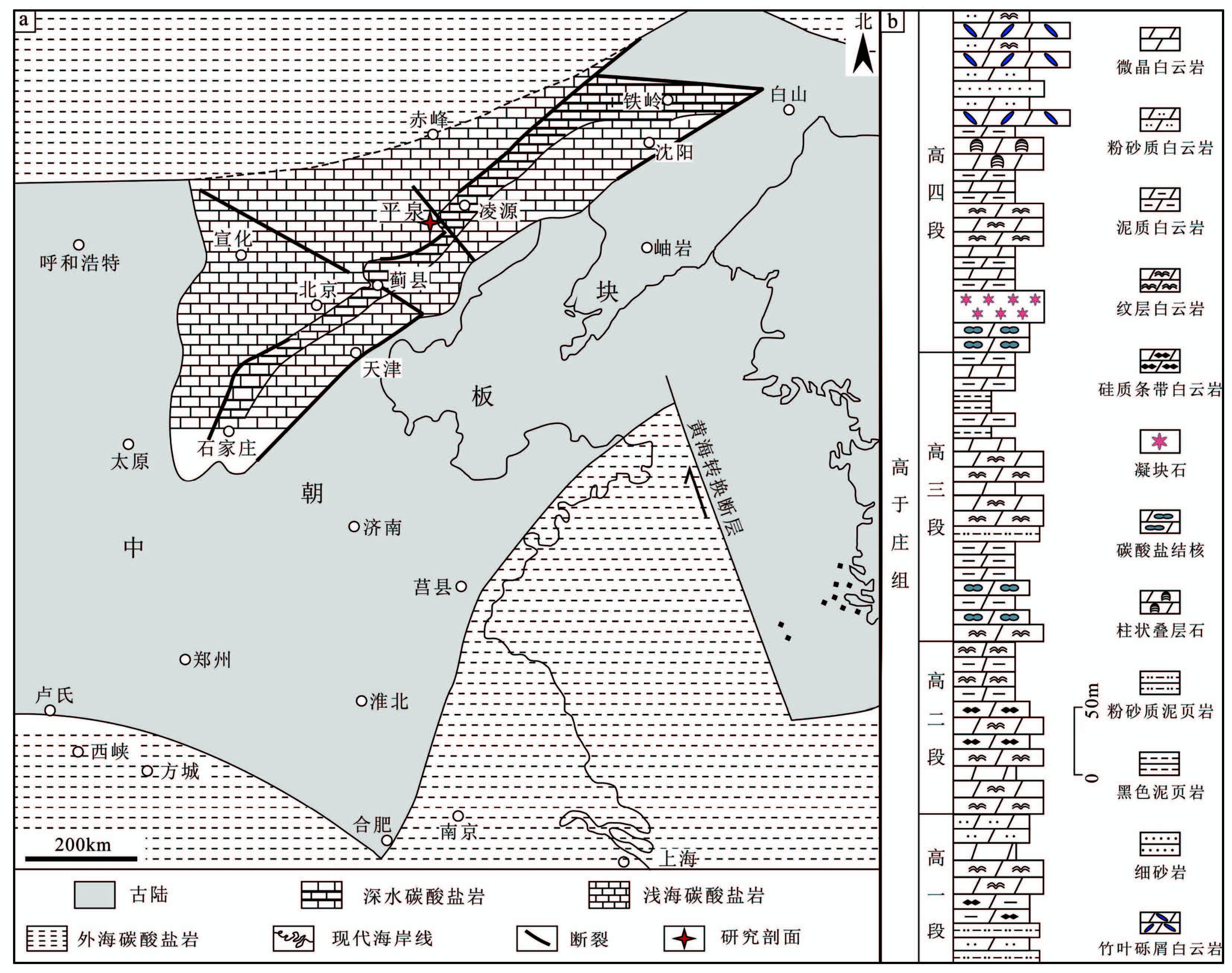
|
图2 地质背景与地层沉积特征 a.华北地台高于庄组时期古地理图(修改自乔秀夫等, 2007a);b.研究区高于庄组地层序列 Fig.2 Geological setting and stratigraphic succession |

|
图3 高于庄组四段凝块石层野外产出特征 a.凝块石层下伏有碳酸盐结核, 结核内部可见水平纹层;b.凝块石层野外呈明显陡坎 Fig.3 Field occurrence characteristics of thrombolites layer of Gaoyuzhuang Formation |
高于庄组四段发育的3种微生物碳酸盐岩在野外都呈明显隆起(图 4a), 由底到顶分别为:凝块石(图 4b)、纹理石(图 4c)、叠层石(图 4d)(郭华等, 2010)。这些微生物岩层与各自下伏的灰黄色薄层—中层状的白云岩(图 4e)组成了很好的副层序。凝块石等微生物岩层为副层序的上单元(highstand systems tract, HST, 高位体系域), 薄层状为主的白云岩则构成了每个副层序的下单元(transgressive systems tract, TST, 海进体系域)(图 4a)。3个副层序纵向向上具有规律性地变化:1)下单元从凝块石副层序中单层厚度<5 cm、薄层—薄板状为主的含泥质白云岩, 向上白云岩层厚度明显变大, 到叠层石副层序中的下单元变化为中层状白云岩为主(单层厚度>15 cm);2)单个副层序的总厚度向上逐渐减小, 但同时微生物岩层在整个副层序中的比例却逐渐变大, 表明该段地层为海退序列, 向上海水逐渐变浅, 即就发育的水体从深到浅序列为凝块石(潮下带下部)、纹理石(潮下带上部—潮间带)、柱状叠层石(潮间带)(图 5)。

|
图4 河北平泉高于庄组四段微生物岩野外展布 a.高于庄组四段微生物岩的野外产出;b.高于庄四段底部凝块石;c.高于庄组四段下部的纹理石;d.高于庄组四段下部的叠层石;e.薄—中层含泥质白云岩, 其位于下单元并与上伏的微生物岩构成副层序 Fig.4 The field distribution of microbialites of Gaoyuzhuang Formation, Pingquan, Hebei Province |
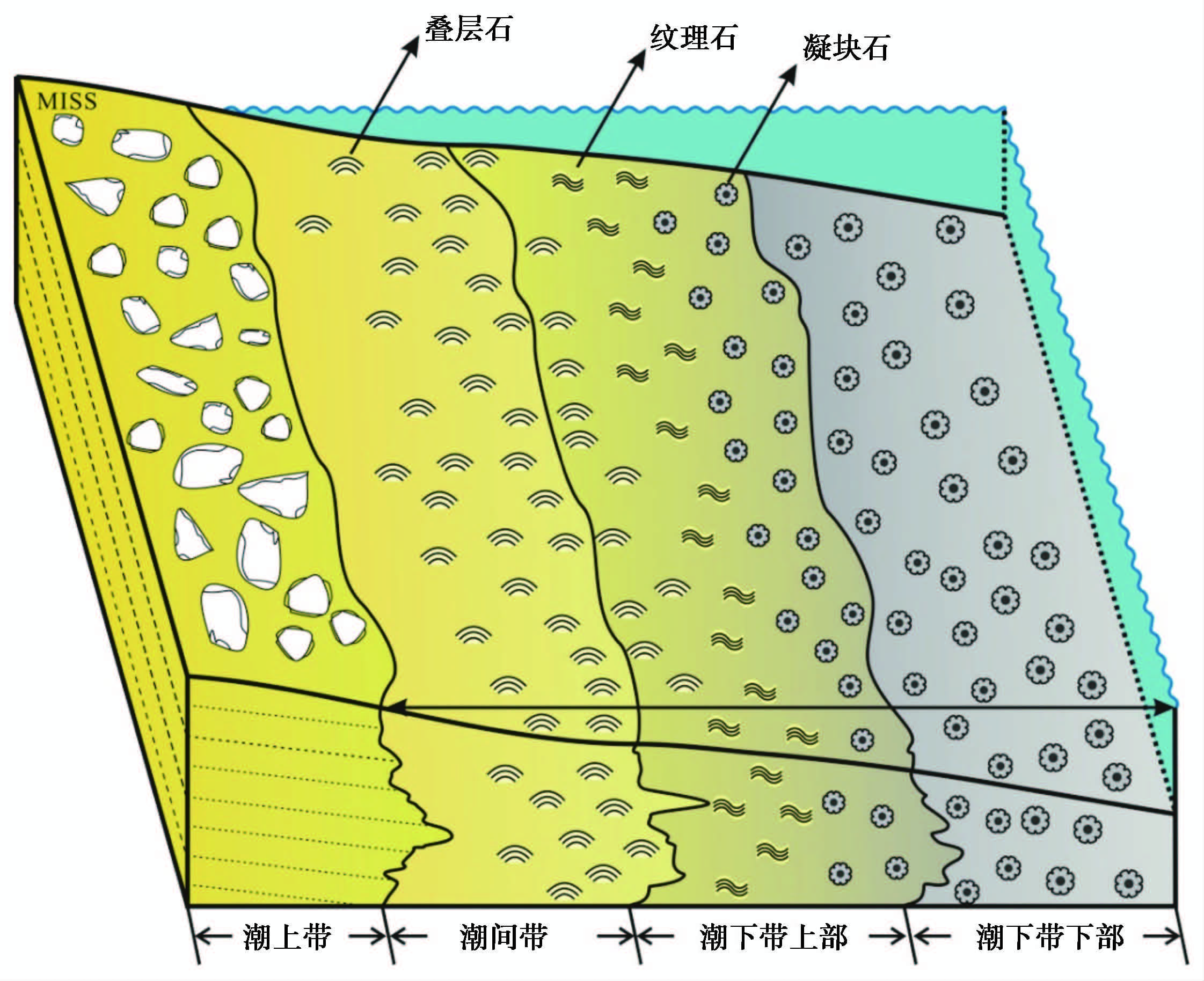
|
图5 平泉高于庄组微生物岩沉积相模式(修改自Tang et al., 2013) Fig.5 A facies model suggested for microbialites of Gaoyuzhuang Formation, Pingquan, Hebei Province(modified from Tang et al., 2013) |
文中研究所用的样品全部取自河北省承德市平泉地区高于庄剖面四段底部的凝块石层中, 并在生物地质与环境地质国家重点实验室中完成测试。其中, 观察凝块石显微组构特征使用了德国卡尔蔡司公司的Axio Scope A1型偏光显微镜, 观察的样品为经抛光处理的岩石薄片。超显微组构的观察与能谱的定量分析(EDS)运用了扫描电镜(SEM)及其配置的牛津能谱探头, 观察对象为抛光岩石薄片与敲碎的岩石样品新鲜面, 扫描电镜型号为ZEISS SUPRA 55, 加速电压为10 kV, 工作距离为3~12 mm。样品表面喷镀铂金, 用于样品超显微结构观察。
3 高于庄组凝块石特征 3.1 宏观形态与结构特征凝块石层发育于高于庄组四段底部(图 2b), 在野外出露明显(图 3b, 图 4a), 其独有的凝块构造可作为鉴别标志(图 4b, 图 6a)。凝块石中的凝块呈灰黑色—黑色, 与凝块间灰黄色的硅质填充明显区别(图 4b, 图 6a)。凝块大小不一, 形态多变, 可呈弥散的不规则斑点单独产出, 有时也可相互粘结形成较大的泡沫状或团块状(图 4b, 图 6a)。

|
图6 研究区高于庄组凝块石宏观特征 a.高于庄组四段底部的凝块石层;b.凝块石层中不同类型凝块组构的过渡变化;c.Ⅰ型凝块组构(中凝块, 凝块直径多为厘米级);d.Ⅱ型凝块组构(小凝块, 凝块直径多为毫米级, 凝块的排列比Ⅰ型稍显整齐);e.Ⅲ型凝块组构(微凝块, 凝块直径多为微米级, 呈层状排列);f.3种类型的凝块组构的宏观特征;a、c、d、e中硬币直径为20 mm;b中标记笔长为15 cm Fig.6 Macroscopic characteristics of thrombolite from Gaoyuzhuang Formation in the study area |
高于庄组四段的凝块石层中由底到顶出现了多种形态的凝块组构的连续变化:凝块直径从大到小, 排列从无序到有序, 分布从致密到松散(图 6b)。我们就此根据凝块的表面形态特征即它们的直径和排列方式, 将其分为3种类型:1)Ⅰ型为致密无序的中凝块(图 6b、 图 6c)。凝块石层底部的凝块多为厘米级球状或相互粘结的不规则团块状。单个球状凝块直径可达2~3 cm, 分布较为致密, 但杂乱无序(图 6c)。2)Ⅱ型为似层状的小凝块(图 6b 图 6d)。相比底部, 凝块石层中部的凝块组构变小了, 多为毫米级别, 几乎未有厘米级别出现。同时, 凝块的排列稍显有序, 大体上似层状分布, 不是完全的杂乱无章, 但也还未严格成层(图 6d)。3)Ⅲ型为严格呈层状的微凝块(图 6b、 图 6e)。顶部的凝块变得更小, 多为微米级别, 肉眼几乎无法识别出单个的凝块结构;排列有序, 呈现出了非常好的成层性(图 6e)。
3种类型的凝块在形态及分布排列上差异明显(图 6f), 但在纵向上呈连续变化(图 6b)。相比而言, 无论是排列的有序性还是凝块大小, Ⅱ型凝块更像是Ⅰ型凝块与Ⅲ型凝块之间的过渡类型, 为过渡型凝块。
3.2 微观形态与结构特征显微观察显示, Ⅰ型凝块多呈厘米级球状(图 7a), 凝块中心有似球状细菌群落的残留(图 7a~ 图 7c), 单个似球状细菌直径在100 μm左右, 褐色—黑色(图 7c)。这些似球状细菌的荧光特征明显(图 7d), 有机质含量较高。球状凝块还可相互粘结集合而形成团状、片状, 其球形边缘明显(图 7e)。也就是说, 这些凝块组构的球状形态决定了凝块组构间填充物的形态及边缘。因此, 大部分凝块间的孔洞应该是初始生长而没有发生溶解等二次作用的, 表明凝块组构都是早期矿化而成。
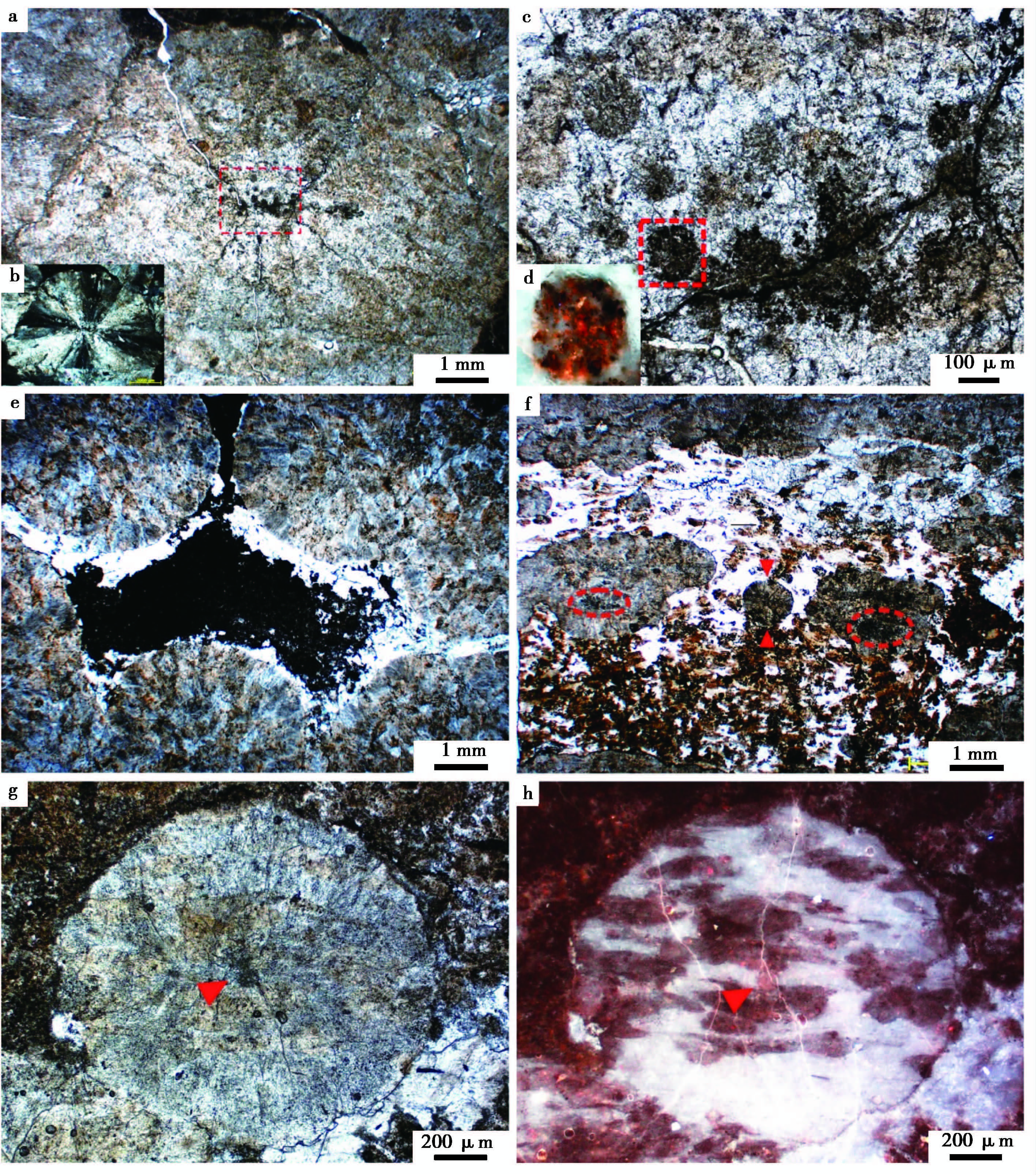
|
图7 高于庄组凝块石中凝块与小凝块组构的微观特征 a.球状中凝块(Ⅰ型), 中心有球状微生物残留, 有机质呈灰黄色—褐色, 在凝块中含量丰富;b.图a中凝块的正交光光学特征, 方解石壳体呈很好的十字消光;c.图a凝块中心的似球状细菌残留;d.图c中所框球状细菌的荧光特征, 发强烈橘红色, 有机质含量较高;e.球状凝块相互粘结呈团、片状;f.呈似层状排列的小凝块(Ⅱ型), 球状或不规则状, 中心有细菌群落残留;g.球状小凝块(Ⅱ型), 中心有似细菌残留;h.图g小凝块的荧光特征, 有机质呈橘红色, 含量较高 Fig.7 Microscopic characteristics of meso-clot and small clot in thrombolite from Gaoyuzhuang Formation |
围绕凝块中心这些球状细菌群落的是呈扇状展布的方解石壳层, 在正交光下有明显的十字消光(图 7b)。Ⅱ型凝块在直径变小、形态多样化的同时, 它们分布较为整齐, 有成层排列趋势(图 7f)。其中单个球状凝块的直径约为1 mm(图 7g), 与Ⅰ型相同, 凝块中心都有明显的细菌群落残留(图 7f、 图 7g)。除了这些细菌群落, 大多数凝块中均存在可观的有机质残留, 它们单偏光下呈灰黄色—褐色, 多为不规则片状, 荧光特征明显(图 7a~ 图 7h)。
Ⅲ型凝块在镜下显示出了微凝块组构层(c层)与微生物席层(m层)周期交替的特点(图 8a)。m层主要以丝状细菌为主, 微亮晶胶结(图 8b、 图 8c)。丝状细菌相互缠绕, 由含有机质的硅质条带(图 8d)阻隔而形成不同的藻团(图 8a~ 图 8c)。c层则主要为形态不同的微凝块组构。这些微凝块的直径一般为200~500 μm, 由内核与围绕内核生长的放射状方解石外壳组成。与中凝块与小凝块中心出现的似球状细菌残留相似, 微凝块的内核主要为微生物残余, 并可见有不同的微生物类型。第一种为丝状细菌残余(图 8e)。丝状细菌宽约为10~15 μm, 长度可达500 μm以上, 具明显的分节构造(图 8e、 图 8f)。第二种为与前文已描述过的似球状细菌(群落)(图 8g)。单个球状细菌的直径为50~200 μm, 荧光特征明显, 确定为有机质残留(图 8h)。有时会出现两个球状细菌群落相互粘结共同作为凝块的内核(图 8i)。但是, 大部分的凝块内核是由已经无法识别原微生物类型的有机质团块构成(图 8j)。
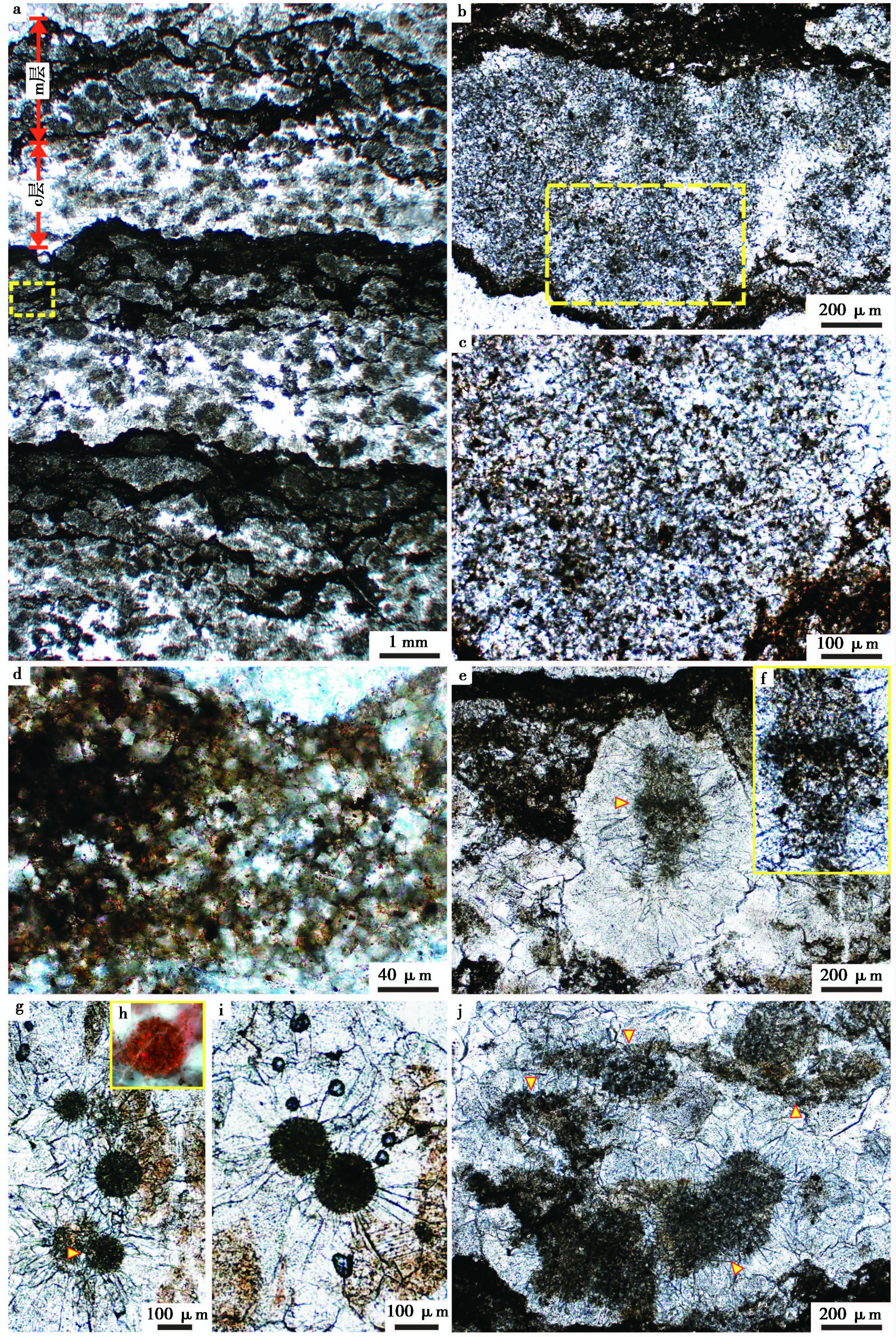
|
图8 高于庄组凝块石中微凝块组构的微观特征 a.Ⅲ型凝块组构, 出现了微凝块层(c层)与由丝状细菌构成的微生物席层(m层)的周期交替;b.微生物席(m层)中的丝状细菌群落;c.图b中所框区域的放大, 可看到明显的相互缠绕、具外壳的丝状细菌;d.微生物席(m层)中含有机质及泥质的硅质层;e.微凝块层(c层)中的微凝块组构, 中心为丝状细菌;f.图e中微凝块中心出现的具分节构造的丝状细菌;g.微凝块层(c层)中的微凝块组构, 中心为似球状细菌;h.图g中所示球状细菌的荧光特征, 有机质残留明显;i.微凝块层(c层)中的微凝块组构, 中心为似球状细菌群落;j.微凝块层(c层)中的微凝块组构, 中心为有机质残留, 无法识别原微生物类型 Fig.8 Microscopic characteristics of micro-clot in thrombolite from Gaoyuzhuang Formation |
总结以上3种类型的凝块结构, 从类型Ⅰ到类型Ⅲ, 凝块从大到小, 从无序到有序, 三者之间展现出了很好的过渡转变关系。虽然凝块大小与分布排列方式各不相同, 但是具有共同的结构特征。一般来说, 凝块的中心主要为由细菌群落构成的内核, 围绕这些细菌群落的是呈放射状—扇状分布的方解石壳层。其中的细菌群落有多种类型, 有的为相互缠绕、具有分节结构的丝状细菌, 有的为球状细菌群落, 它们在荧光下都呈明显的有机质特性。其中Ⅲ型中还出现了凝块层与微生物席层周期交替的层状结构, 与叠层石相似。
3.3 凝块组构的超微观特征通过以上显微观察已经表明3种类型的凝块组构具有相同的结构特征:凝块中心为由微生物或有机质残留构成的核心, 外壳为围绕核心生长的放射状—扇状的方解石(图 9a、 图 9b)。重要的是, 外围壳层中放射状(扇状)的方解石晶体间具有明显的荧光特征, 可确定为有机质残留, 这对整个凝块的形成有重要意义(图 9b)。超显微观察显示, 凝块的整体形态多表现为球状—椭球状(图 9c~ 图 9e)。凝块中心可见有机质碎屑、白云石颗粒及硅质颗粒(图 9e~ 图 9g)。扫描电镜下可清楚地观察到, 凝块放射状外壳中的单个颗粒由凝块中心向外发散呈内窄外宽的扇状方式展布, 扇状颗粒间缝隙明显(图 9c~ 图 9e)。进一步观察, 凝块外壳的方解石颗粒缝隙中保存有薄片状似胞外聚合物(extracellular polymeric substances, EPS)的物质填充(图 9h~ 图 9i), 与荧光下观察到的颗粒间的有机质残留吻合。也就是说, 凝块组构的外壳可能是由方解石不断填充在这些EPS的空格中而形成的(图 9i)。
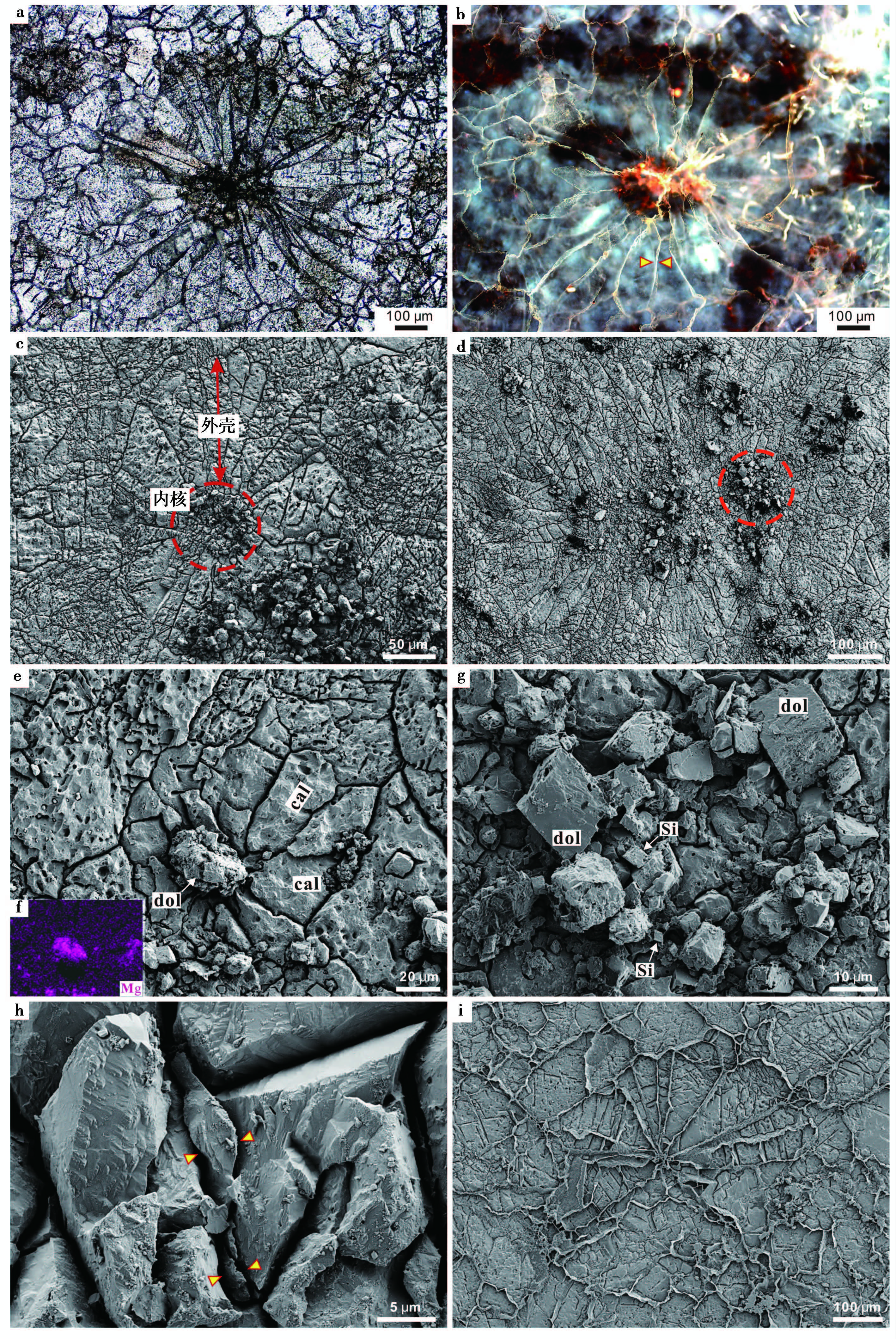
|
图9 高于庄组凝块石中凝块组构的超微观特征 a.凝块组构由有机质残留构成的核心与放射状的方解石外壳构成;b.图a微凝块的荧光特征, 凝块中心有机质残留明显;c、d.凝块组构在SEM下的结构特征, 球状的核心与放射状外壳明显;e.SEM下的凝块组构, 中心为白云石(dol)颗粒的集合体, 外壳为方解石(cal)颗粒;f.图e中凝块组构对Mg元素的EDS面扫描图片, 只有凝块中心含Mg明显, 为白云石颗粒;g.图d中所示的凝块中心的放大, 主要由白云石、硅质(Si)及有机质碎屑组成;h.凝块组构外壳中放射状方解石颗粒间的EPS残留;i.凝块组构中放射状的EPS格架, 及其向外延伸的多边形格架;方解石填充在EPS的空间中 Fig.9 Ultramicroscopic characteristics of clots in thrombolite from Gaoyuzhuang Formation |
平泉高于庄组四段的凝块石层中呈现出了中凝块、小凝块、微凝块3种大小与排列方式不同的凝块组构。从肉眼可见的厘米级致密、杂乱的中凝块, 经毫米级、似层状分布的小凝块, 到微米级、严格成层排列的微凝块, 三者具有相同的结构特征, 均由内核与外壳两个构造单元组成。内核主要为丝状细菌及似球状细菌的微生物群落或有机质残留构成, 外壳则主要为放射状—扇状展布的方解石。单个的凝块组构多呈球状—椭球状, 也可相互结合形成不规则状。其球状边缘的良好保存, 说明了凝块的矿化要早于含有机质较高的硅质围岩的形成。
经过进一步的荧光观察与SEM观察发现, 凝块外壳主要由放射状排列的方解石构成, 并且在这些颗粒的缝隙中存在着有机质残留, 其薄片状形态及似蜂窝状的结构特点, 与现代石化微生物席中发现的EPS残余特征一致(如Dupraz et al., 2004;Aloisi et al., 2006;Spadafora et al., 2010;Glunk et al., 2011;Perri et al., 2012), 很可能为EPS残留。而EPS在凝块构造及凝块石层中的大量出现(图 9h、 图 9i, 图 10a、 图 10b), 显示了其与凝块组构及凝块石的形成密切相关。

|
图10 高于庄组凝块石中发育的蜂窝状EPS a.凝块石中大量发育的蜂窝状构造的EPS;b.EPS格架被方解石完全填充, EPS呈四边形或五边形, 结构保存良好 Fig.10 EPS with honeycomb structure in thrombolite from Gaoyuzhuang Formation |
EPS(胞外聚合物)是由微生物(主要是细菌)分泌于体外的一些高分子聚合物, 呈扁平状和丝状似粘液的构造(Reimann et al., 1966;Grady et al., 1999;Lawrence et al., 2003), 其主要成分是一些高分子物质, 如多糖、蛋白质、核酸及磷脂等聚合物(Beveridge and Graham, 1991;McSwain et al., 2005)。越来越多的研究表明, EPS对碳酸盐岩沉淀有着密切的关系。目前认为它对碳酸盐岩的影响主要通过以下几种方式:1)EPS能够作为碳酸钙晶体成核的垫板(Pentecost, 1985;Mann et al., 1988;Knorre and Krumbein, 2000;Dupraz and Visscher, 2005;Turner and Jones, 2005)。2)EPS能够结合并且螯合很多二价阳离子从而抑制碳酸盐的沉淀(Dupraz et al., 2004;Dupraz and Visscher, 2005)。这主要是由于EPS中含有较多的硫酸根、磷酸根和羧基等负电官能团(Geesey and Jang, 1989)。更重要的是, 当EPS发生降解时又会释放这些二价阳离子, 造成局部区域的饱和度升高而导致矿物沉淀(Dupraz and Visscher, 2005;Aloisi et al., 2006;Meister et al., 2011)。3)通过形成异养生物适宜生活的环境, 就有了不同类型微生物的代谢活动, 多种微生物作用的相互耦合, 也会使周围环境中的饱和度增高而发生沉淀(Dupraz et al., 2004;Baumgartner et al., 2009)。近年来, 硫酸盐还原细菌(sulfate reducting bacteria, SRB)与EPS对碳酸盐沉淀的促进作用得到了有力的证实(Aloisi et al., 2006;Spadafora et al., 2010;Perri et al., 2012)。SRB分解EPS消耗硫酸盐(SO42-), 产生重碳酸盐(HCO3-), 从而增加微环境的碱度(Dupraz et al., 2004, 2009), 并释放所富集的Mg2+、Ca2+(Aloisi et al., 2006), 导致碳酸盐沉淀(Ca2++HCO3-→ CaCO3)。
毫无疑问, 构成凝块内核的细菌(群落)的出现及相关的代谢活动对凝块的形成有着关键意义。凝块外壳的成因则与其中分布的EPS密切相关。细菌群落的新陈代谢活动会以自己为中心向四周分泌出具空间格架的EPS, 一开始EPS会围绕菌群本身呈球状或椭球状(图 9i), 随着分泌的不断增多, EPS会逐渐向外延展在较大区域内形成典型的蜂窝状构造(图 9i, 图 10a、 图 10b)。
凝块构造最先矿化的地方, 也就是碳酸盐最先沉淀的阶段应该发生在这些扇状(蜂窝状)的EPS上或是对EPS的置换矿化(Sprachta et al., 2001;Dupraz et al., 2004;Aloisi et al., 2006;Bontognali et al., 2008;Martinez et al., 2010)。由于EPS带负电荷功能群的表面, 如羧基、氢氧基、磷酸盐, 有利于其周围微环境中高饱和度的形成(Schultze-Lam et al., 1996)。因此, 碳酸钙最开始的沉淀可能会发生在这个区域(Jimenez-Lopez et al., 2011)。同时, 通过大量的观察与实验, EPS作为碳酸盐沉淀的核心或开始的场所也已经被证明(DeFarge et al., 1996;Sprachta et al., 2001;Trichet et al., 2001;Kawaguchi and Decho, 2002;Gautret et al., 2004)。这些在EPS有机格架上成核及沉淀, 或是对格架的替代、置换, 基本上不会破坏EPS的三维结构(Dupraz et al., 2009)。
凝块内核中微生物群落的新陈代谢活动, 主要是光合作用, 会不断地吸收周围环境中的CO2, 导致pH逐渐升高、饱和度升高, 再加上EPS对碳酸盐沉淀的促进作用, 这些都会不断地促进着碳酸盐在EPS构造中的持续沉淀, 并会逐渐地填充在细菌的间隙中(Dupraz et al., 2004)。在这种情况下, 具体的生物结构很难保存, 因为它们最终会被碳酸盐全部堵塞、填充, 而仅宏观构造(球状、丝状)可能会被保存下来(Souza-Egipsy et al., 2006)。
除了丝状细菌, 凝块内核中呈球状细菌形态聚集分布的白云石、二氧化硅及有机质碎屑在矿物成分上与外壳中的方解石有明显的区别。一方面, 球状的聚集形态表明可能是对球状细菌(群落)原位矿化、置换而成。另一方面, 特殊的矿物成分与高有机质含量都与细菌作用密切相关, 尤其是白云石与硅质的形成都与细菌的代谢活动有着紧密联系。大量的观察及实验已经表明, 只有在细菌存在的条件下, 才可能有含钙白云石或者是含镁方解石的沉淀(Land, 1998;Warthmann et al., 2000;Van Lith et al., 2003;Meister et al., 2011)。同时, 微生物还对硅质矿物的形成及对硅质成分有促进、聚集等作用(Ferris et al., 1986;Jones and Renaut, 1996;Renaut et al., 1998;Phoenix et al., 2003;Yee et al., 2003;Jones et al., 2004)。尤其是对于前寒武纪碳酸盐岩中出现的硅质组分, 绝大部分被认为与微生物的作用密不可分(Konhauser et al., 2001;Maliva et al., 2005)。
与高于庄组凝块组构相似, 丝状蓝细菌周围的扇形方解石的形成被认为与丝状细菌周围的EPS是密切相关的(Souza-Egipsy et al., 2006)。同时在碳酸盐岩中微球粒外壳的高Mg方解石和Ca白云石晶体颗粒间也发现了被认为是分解残留的EPS(Spadafora et al., 2010)。综上所述, 无论是凝块内核中明显的丝状细菌残余或者呈球状细菌形态聚集的白云石等矿物, 还是凝块外壳中大量分布呈扇状架构的EPS及其中填充的方解石, 都指示了微生物的代谢作用及EPS对凝块的形成有着重要作用。
4.2 凝块石与环境的相互关系高于庄组中出现的3种形态类型的凝块组构的转变:从排列无序、分布致密的厘米级中凝块, 到未严格成层排列的毫米级小凝块, 再到严格成层排列的微米级微凝块, 三者在剖面上出现了连续的过渡变化。而关于影响微生物岩形态变化的主要因素究竟是什么, 一直存在着分歧。例如, 有人认为微生物可能是决定微生物岩类型与形态的关键因素(Feldmann and McKenzie, 1998;Mobberley et al., 2012), 也有人提出主要是环境因素(González-Muñoz et al., 2010)。观察可知, 3种形态的凝块石中出现的微生物类型应该是相同的, 主要为丝状细菌与球状细菌, 在微生物因素相同的情况下, 环境条件的变化就成为了影响形态变化的主要因素。
导致碳酸钙沉淀的关键因素有两个:一个是地球化学方面的因素——饱和度, 另一个是生物学—化学方面的因素——EPS(Dupraz and Visscher, 2005)。实验表明, 环境中不同的初始饱和度会造成不同形式、不同速度的碳酸盐沉淀(Jimenez-Lopez et al., 2011)。海水的饱和度可能是凝块组构产生不同形态的主要控制因素。在致密型(Ⅰ型)中凝块的形成时期, 由于海水的饱和度较高, 在微生物活动(如光合作用)及EPS对碳酸盐沉淀的促进作用下, 碳酸盐矿物会快速沉淀、快速生长。并且, 由于原来的饱和度较高, 碳酸钙沉淀之后相近区域的溶解度降低后还没有达到饱和度之下, 故会持续沉淀、矿化(Jimenez-Lopez et al., 2011), 而使最后整个凝块的矿化范围较大, 最终形成的凝块直径较大, 常构成厘米级。随着海水饱和度的降低, 碳酸盐沉淀的速度及范围都会变小, 从而造成了凝块组构的向毫米级(Ⅱ型)、微米级(Ⅲ型)的缩小化。
也就是说, 凝块组构形态的变化可能反映了海水饱和度的变化。凝块组构由大到小, 表明了当时海水的饱和度是由高到低的变化趋势。同时, 凝块石在地球历史中的丰度变化被归因于环境条件的变化, 尤其是海水化学条件的变化(Grotzinger, 1990;Riding and Liang, 2005)。凝块石在早寒武的丰度增加反映的是环境条件的变化而不是微生物的演化(Harwood and Sumner, 2011)。所以, 凝块石本身的发育可能已经代表了一种特殊的海水化学条件, 如高饱和度。
5 结 论(1) 华北中元古代高于庄组(1.60~1.53 Ga)潮下带中下部广泛产出凝块石。根据直径大小及排列特点可将凝块石中的凝块组构分为以下3类:排列致密、杂乱的厘米级中凝块、未严格成层的毫米级小凝块、排列严格成层的微米级微凝块。3种类型的凝块组构具有相同的结构特征, 均由富有机质的内核与扇状分布的方解石为主构成的外壳两部分组成。
(2) 显微—超显微观察显示, 内核中的有机质多为丝状细菌或是球状细菌(群落)的残留, 外壳的扇状方解石晶体颗粒间有较为普遍的EPS存在。内核微生物的代谢活动与EPS都对碳酸盐的沉淀有着促进作用, 会导致方解石的快速沉淀, 从而使EPS矿化并被完全填充。造成凝块组构形态变化的主要因素是海水的饱和度:当饱和度高时, 方解石沉淀快速、范围较大, 形成了厘米级别的中凝块;随着饱和度的降低, 沉淀速率及范围都有所减小, 最终形成直径较小的小凝块与微凝块。
(3) 高于庄组凝块石的发育给报道极少前寒武纪凝块石添加了记录, 也就提供了证据说明凝块石不只局限于寒武纪之后, 更老的微生物群落也能产生凝块石。同时, 高于庄组凝块石中凝块内核与外壳的微生物成因, 也否定了关于凝块组构的无机成因说及后生动物扰动成因说, 有助于更好地理解微生物与环境的相互作用对凝块石等微生物岩的意义。
| [1] |
曹瑞骥, 袁训来. 2006. 叠层石. 合肥: 中国科学技术大学出版社 : 1 -383.
( 0) 0)
|
| [2] |
Cao Ruiji and Yuan Xunlai. 2006. Stromatolites. Hefei: University of Science and Technology of China Press : 1-383.
( 0) 0)
|
| [3] |
陈金勇, 韩作振, 范洪海, 等. 2014. 鲁西寒武系凝块石特征及其形成机制的探讨. 地质学报, 88(6) : 967–979.
( 0) 0)
|
| [4] |
Chen Jinyong, Han Zuozhen, Fan Honghai, et al. Characteristics and formation mechanism of Cambrian thrombolite in western Shandong Province. Acta Geologica Sinica, 88(6) : 967–979.
( 0) 0)
|
| [5] |
杜汝霖. 1992. 前寒武纪古生物学及地史学. 北京: 地质出版社 : 1 -193.
( 0) 0)
|
| [6] |
Du Rulin. 1992. Palaeontology and Geochronic Geology in Precambrian. Beijing: Geological Publishing House : 1-193.
( 0) 0)
|
| [7] |
高林志, 张传恒, 史晓颖, 等. 2007. 华北青白口系下马岭组凝灰岩锆石SHRIMP U-Pb定年. 地质通报, 26(3) : 249–255.
( 0) 0)
|
| [8] |
Gao Linzhi, Zhang Chuanheng, Shi Xiaoying, et al. 2007. Zircon SHRIMP U-Pb dating of the tuff bed in the Xiamaling Formation of the Qingbaikouan System in North China. Geological Bulletin of China, 26(3) : 249–255.
( 0) 0)
|
| [9] |
高林志, 张传恒, 史晓颖, 等. 2008a. 华北古陆下马岭组归属中元古界的锆石SHRIMP年龄新证据. 科学通报, 53(21) : 2617–2623.
( 0) 0)
|
| [10] |
Gao Linzhi, Zhang Chuanheng, Shi Xiaoying, et al. 2008a. Mesoproterozoic age for Xiamaling Formation in North China plate indicated by zircon SHRIMP dating. Chinese Science Bulletin, 53(17) : 2665–2671.
( 0) 0)
|
| [11] |
高林志, 张传恒, 尹崇玉, 等. 2008b. 华北古陆中、新元古代年代地层框架SHRIMP锆石年龄新依据. 地球学报, 29(3) : 366–376.
( 0) 0)
|
| [12] |
Gao Linzhi, Zhang Chuanheng, Yin Chongyu, et al. 2008b. SHRIMP zircon ages:Basis for refining the chronostratigraphic classification of the Meso-and Neoproterozoic strata in North China old land. Acta Geoscientica Sinica, 29(3) : 366–376.
( 0) 0)
|
| [13] |
高林志, 张传恒, 刘鹏举, 等. 2009. 华北-江南地区中、新元古代地层格架的再认识. 地球学报, 30(4) : 433–446.
( 0) 0)
|
| [14] |
Gao Linzhi, Zhang Chuanheng, Liu Pengju, et al. 2009. Recognition of Meso-and Neoproterozoic stratigraphic framework in North and South China. Acta Geoscientica Sinica, 30(4) : 433–446.
( 0) 0)
|
| [15] |
高林志, 丁孝忠, 曹茜, 等. 2010. 中国晚前寒武纪年表和年代地层序列. 中国地质, 37(4) : 1014–1020.
( 0) 0)
|
| [16] |
Gao Linzhi, Ding Xiaozhong, Cao Qian, et al. 2010. New geological time scale of Late Precambrian in China and geochronology. Geology in China, 37(4) : 1014–1020.
( 0) 0)
|
| [17] |
郭华, 杜远生, 黄俊华, 等. 2010. 河北平泉中元古界高于庄组生境型及古环境. 古地理学报, 12(3) : 269–280.
( 0) 0)
|
| [18] |
Guo Hua, Du Yuansheng, Huang Junhua, et al. 2010. Habitat types and palaeoenvironments of the Mesoproterozoic Gaoyuzhuang Formation in Pingquan,Hebei Province. Journal of Palaeogeography, 12(3) : 269–280.
( 0) 0)
|
| [19] |
孔金平, 刘效曾. 1998. 塔里木盆地塔中5井下奥陶统隐藻类生物礁. 新疆石油地质, 19(3) : 221–224.
( 0) 0)
|
| [20] |
Kong Jinping and Liu Xiaozeng. 1998. Lower Ordovician crypto-algaeorganic reef in well TZ5 in Tarim Basin. Xinjiang Petroleum Geology, 19(3) : 221–224.
( 0) 0)
|
| [21] |
李怀坤, 朱士兴, 相振群, 等. 2010. 北京延庆高于庄组凝灰岩的锆石U-Pb定年研究及其对华北北部中元古界划分新方案的进一步约束. 岩石学报, 26(7) : 2131–2140.
( 0) 0)
|
| [22] |
Li Huaikun, Zhu Shixing, Xiang Zhenqun, et al. 2010. Zircon U-Pb dating on tuff bed from Gaoyuzhuang Formation in Yanqing,Beijing:Further constraints on the new subdivision of the Mesoproterozoic stratigraphy in the northern North China Craton. Acta Petrologica Sinica, 26(7) : 2131–2140.
( 0) 0)
|
| [23] |
李怀坤, 苏文博, 周红英, 等. 2011. 华北克拉通北部长城系底界年龄小于1670 Ma:来自北京密云花岗斑岩岩脉锆石LA-MC-ICPMS U-Pb年龄的约束. 地学前缘, 18(3) : 108–120.
( 0) 0)
|
| [24] |
Li Huaikun, Su Wenbo, Zhou Hongying, et al. 2011. The base age of the Changchengian System at the northern North China Craton should be younger than 1670 Ma:Constraints from zircon U-Pb LA-MC-ICPMS dating of a granite-porphyry dike in Miyun County,Beijing. Earth Science Frontiers, 18(3) : 108–120.
( 0) 0)
|
| [25] |
陆松年, 李惠民. 1991. 蓟县长城系大红峪组火山岩的单颗粒锆石U-Pb法准确定年. 地球学报, 22(1) : 137–145.
( 0) 0)
|
| [26] |
Lu Songnian and Li Huimin. 1991. A precise U-Pb single zircon age dermination for the volcanics of Dahongyu Formation,Changcheng System in Jixian. Acta Geoscientica Sinica, 22(1) : 137–145.
( 0) 0)
|
| [27] |
梅冥相. 2007. 从凝块石概念的演变论微生物碳酸盐岩的研究进展. 地质科技情报, 26(6) : 1–9.
( 0) 0)
|
| [28] |
Mei Mingxiang. 2007. Discussion on advances of microbial carbonates from the terminological change of thrombolites. Geological Science and Technology Information, 26(6) : 1–9.
( 0) 0)
|
| [29] |
乔秀夫, 高林志. 2007a. 燕辽裂陷槽中元古代古地震与古地理. 古地理学报, 9(4) : 337–352.
( 0) 0)
|
| [30] |
Qiao Xiufu and Gao Linzhi. 2007a. Mesoproterozoic palaeoearthquake and palaeogeography in Yan-Liao aulacogen. Journal of Palaeogeography, 9(4) : 337–352.
( 0) 0)
|
| [31] |
乔秀夫, 高林志, 张传恒. 2007b. 中朝板块中、新元古界年代地层柱与构造环境新思考. 地质通报, 26(5) : 503–509.
( 0) 0)
|
| [32] |
Qiao Xiufu, Gao Linzhi and Zhang Chuanheng. 2007b. New idea of the Meso-and Neoproterozoic chronostratigraphic chart and tectonic environment in Sino-Korean plate. Geological Bulletin of China, 26(5) : 503–509.
( 0) 0)
|
| [33] |
Aitken J D. 1967. Classification and environmental significance of cryptalgal limestones and dolomites,with illustrations from the Cambrian and Ordovician of southwestern Alberta. Journal of Sedimentary Research, 37(4) : 1163–1178.
( 0) 0)
|
| [34] |
Aitken J D and Narbonne G M. 1989. Two occurrences of Precambrian thrombolites from the Mackenzie Mountains,northwestern Canada. Palaios, 4(4) : 384–388.
DOI:10.2307/3514563 ( 0) 0)
|
| [35] |
Aloisi G, Gloter A, Krüger M, et al. 2006. Nucleation of calcium carbonate on bacterial nanoglobules. Geology, 34(12) : 1017–1020.
DOI:10.1130/G22986A.1 ( 0) 0)
|
| [36] |
Arp G, Bissett A, Brinkmann N, et al. 2010. Tufa-forming biofilms of German karstwater streams:Microorganisms,exopolymers,hydrochemistry and calcification. Geological Society,London,Special Publications, 336(1) : 83–118.
DOI:10.1144/SP336.6 ( 0) 0)
|
| [37] |
Awramik S M. 1992. The history and significance of stromatolites.In:Schidlowski M and IGCP Project 157(Eds.).Early Organic Evolution:Implications for Mineral and Energy Resources. Berlin;New York:Springer-Verlag : 435–449.
( 0) 0)
|
| [38] |
Baumgartner L K, Spear J R, Buckley D H, et al. 2009. Microbial diversity in modern marine stromatolites,Highborne Cay,Bahamas. Environmental Microbiology, 11(10) : 2710–2719.
DOI:10.1111/emi.2009.11.issue-10 ( 0) 0)
|
| [39] |
Berelson W M, Corsetti F A, Pepe-Ranney C, et al. 2011. Hot spring siliceous stromatolites from Yellowstone National Park:Assessing growth rate and laminae formation. Geobiology, 9(5) : 411–424.
( 0) 0)
|
| [40] |
Beveridge T J and Graham L L. 1991. Surface layers of bacteria. Microbiological Reviews, 55(4) : 684–705.
( 0) 0)
|
| [41] |
Bontognali T R R, Vasconcelos C, Warthmann R J, et al. 2008. Microbes produce nanobacteria-like structures,avoiding cell entombment. Geology, 36(8) : 663–666.
DOI:10.1130/G24755A.1 ( 0) 0)
|
| [42] |
Burne R V and Moore L S. 1987. Microbialites:Organosedimentary deposits of benthic microbial communities. Palaios, 2(3) : 241–254.
DOI:10.2307/3514674 ( 0) 0)
|
| [43] |
DeFarge C, Trichet J, Jaunet A M, et al. 1996. Texture of microbial sediments revealed by cryo-scanning electron microscopy. Journal of Sedimentary Research, 66(5) : 935–947.
( 0) 0)
|
| [44] |
Dupraz C, Visscher P, Baumgartner L, et al. 2004. Microbe-mineral interactions:Early carbonate precipitation in a hypersaline lake(Eleuthera Island,Bahamas). Sedimentology, 51(4) : 745–765.
DOI:10.1111/sed.2004.51.issue-4 ( 0) 0)
|
| [45] |
Dupraz C and Visscher P T. 2005. Microbial lithification in marine stromatolites and hypersaline mats. Trends in Microbiology, 13(9) : 429–438.
DOI:10.1016/j.tim.2005.07.008 ( 0) 0)
|
| [46] |
Dupraz C, Reid R P, Braissant O, et al. 2009. Processes of carbonate precipitation in modern microbial mats. Earth-Science Reviews, 96(3) : 141–162.
DOI:10.1016/j.earscirev.2008.10.005 ( 0) 0)
|
| [47] |
Feldmann M and McKenzie J A. 1998. Stromatolite-thrombolite associations in a modern environment,Lee Stocking Island,Bahamas. Palaios, 13(2) : 201–212.
DOI:10.2307/3515490 ( 0) 0)
|
| [48] |
Ferris F G, Beveridge T J and Fyfe W S. 1986. Iron-silica crystallite nucleation by bacteria in a geothermal sediment. Nature, 320(6063) : 609–611.
DOI:10.1038/320609a0 ( 0) 0)
|
| [49] |
Gautret P, Camoin G, Golubic S, et al. 2004. Tracing automicrite formation and its biochemical setting in modern lagoonal microbialites. Journal of Sedimentary Research, 74 : 462–478.
DOI:10.1306/012304740462 ( 0) 0)
|
| [50] |
Geesey G G and Jang L.1989.Interactions between metal ions and capsular polymers.In:Beveridge T J and Doyle R J(Eds.).Metal Ions and Bacteria.New York:Wiley.325—357.
( 0) 0)
|
| [51] |
Glunk C, Dupraz C, Braissant O, et al. 2011. Microbially mediated carbonate precipitation in a hypersaline lake,Big Pond(Eleuthera,Bahamas). Sedimentology, 58(3) : 720–736.
DOI:10.1111/sed.2011.58.issue-3 ( 0) 0)
|
| [52] |
González-Muñoz M T, Rodriguez-Navarro C, Martínez-Ruiz F, et al. 2010. Bacterial biomineralization:New insights from Myxococcus-induced mineral precipitation. Geological Society,London,Special Publications, 336(1) : 31–50.
DOI:10.1144/SP336.3 ( 0) 0)
|
| [53] |
Grady C P L, Daigger G T and Lim H C. 1999. Biological Wastewater Treatment(2nd ed). New York: Marcel Dekker : 1-1076.
( 0) 0)
|
| [54] |
Grotzinger J P, Watters W A and Knoll A H. 2000. Calcified metazoans in thrombolite-stromatolite reefs of the terminal Proterozoic Nama Group,Namibia. Paleobiology, 26(3) : 334–359.
DOI:10.1666/0094-8373(2000)026<0334:CMITSR>2.0.CO;2 ( 0) 0)
|
| [55] |
Grotzinger J, Adams E W, Schreder S, et al. 2005. Microbial-metazoan reefs of the terminal Proterozoic Nama Group(c. 550-543 Ma),Namibia.Geological Magazine, 142(5) : 499–517.
DOI:10.1017/S0016756805000907 ( 0) 0)
|
| [56] |
Grotzinger J P. 1990. Geochemical model for Proterozoic stromatolite decline. American Journal of Science, 290 : 80–103.
( 0) 0)
|
| [57] |
Harwood C L and Sumner D Y. 2011. Microbialites of the Neoproterozoic Beck Spring Dolomite,southern California. Sedimentology, 58(6) : 1648–1673.
DOI:10.1111/sed.2011.58.issue-6 ( 0) 0)
|
| [58] |
Hoffman P F. 1991. Did the breakout of Laurentia turn Gondwanaland inside-out?. Science, 252(5011) : 1409–1412.
DOI:10.1126/science.252.5011.1409 ( 0) 0)
|
| [59] |
Jimenez-Lopez C, Chekroun K, Jroundi F, et al. 2011. Myxococcus xanthus colony calcification:An study to better understand the processes involved in the formation of this stromatolite-like structure. Advances in Stromatolite Geobiology, 131 : 161–181.
DOI:10.1007/978-3-642-10415-2 ( 0) 0)
|
| [60] |
Jones B and Renaut R W. 1996. Influence of thermophilic bacteria on calcite and silica precipitation in hot springs with water temperatures above 90 ℃:Evidence from Kenya and New Zealand. Canadian Journal of Earth Sciences, 33(1) : 72–83.
DOI:10.1139/e96-008 ( 0) 0)
|
| [61] |
Jones B, Konhauser K O, Renaut R W, et al. 2004. Microbial silicification in Iodine Pool,Waimangu geothermal area,North Island,New Zealand:Implications for recognition and identification of ancient silicified microbes. Joumal of the Geological Society, 161 : 983–993.
DOI:10.1144/0016-764903-172 ( 0) 0)
|
| [62] |
Kah L C and Grotzinger J P. 1992. Early Proterozoic(1. 9 Ga)thrombolites of the Rocknest Formation,Northwest Territories.Palaios, 7(3) : 305–315.
( 0) 0)
|
| [63] |
Kawaguchi T and Decho A W. 2002. A laboratory investigation of cyanobacterial extracellular polymeric secretions(EPS)in influencing CaCO3 polymorphism. Journal of Crystal Growth, 240(1-2) : 230–235.
DOI:10.1016/S0022-0248(02)00918-1 ( 0) 0)
|
| [64] |
Kennard J M and James N P. 1986. Thrombolites and stromatolites:Two distinct types of microbial structures. Palaios, 1(5) : 492–503.
DOI:10.2307/3514631 ( 0) 0)
|
| [65] |
Kershaw S, Crasquin S, Li Y, et al. 2012. Microbialites and global environmental change across the Permian-Triassic boundary:A synthesis. Geobiology, 10(1) : 25–47.
DOI:10.1111/j.1472-4669.2011.00302.x ( 0) 0)
|
| [66] |
Knorre H V and Krumbein W E. 2000. Bacterial calcification.In:Riding R and Awramik S M(Eds.).Microbial Sediments.Berlin. New York: Springer : 25-31.
( 0) 0)
|
| [67] |
Konhauser K O, Phoenix V R, Bottrell S H, et al. 2001. Microbial-silica interactions in Icelandic hot spring sinter:Possible analogues for some Precambrian siliceous stromatolites. Sedimentology, 48(2) : 415–433.
DOI:10.1046/j.1365-3091.2001.00372.x ( 0) 0)
|
| [68] |
Land L S. 1998. Failure to precipitate dolomite at 25 ℃ from dilute solution despite 1000-fold oversaturation after 32 years. Aquatic Geochemistry, 4(3) : 361–368.
( 0) 0)
|
| [69] |
Lawrence J R, Swerhone G D W, Leppard G G, et al. 2003. Scanning transmission X-ray,laser scanning,and transmission electron microscopy mapping of the exopolymeric matrix of microbial biofilms. Applied and Environmental Microbiology, 69(9) : 5543–5554.
DOI:10.1128/AEM.69.9.5543-5554.2003 ( 0) 0)
|
| [70] |
Li H, Lu S, Su W, et al. 2013. Recent advances in the study of the Mesoproterozoic geochronology in the North China Craton. Journal of Asian Earth Sciences, 72 : 216–227.
DOI:10.1016/j.jseaes.2013.02.020 ( 0) 0)
|
| [71] |
Lu S N, Zhao G C, Wang H C, et al. 2008. Precambrian metamorphic basement and sedimentary cover of the North China Craton. Precambrian Research, 160(1-2) : 77–93.
DOI:10.1016/j.precamres.2007.04.017 ( 0) 0)
|
| [72] |
Maliva R G, Knoll A H and Simonson B M. 2005. Secular change in the Precambrian silica cycle:Insights from chert petrology. Geological Society of America Bulletin, 117(7-8) : 835–845.
( 0) 0)
|
| [73] |
Mann S, Heywood B R, Rajam S, et al. 1988. Controlled crystallization of CaCO3 under stearic acid monolayers. Nature, 334(6184) : 692–695.
DOI:10.1038/334692a0 ( 0) 0)
|
| [74] |
Martinez R E, Gardés E, Pokrovsky O S, et al. 2010. Do photosynthetic bacteria have a protective mechanism against carbonate precipitation at their surfaces?. Geochimica et Cosmochimica Acta, 74(4) : 1329–1337.
DOI:10.1016/j.gca.2009.11.025 ( 0) 0)
|
| [75] |
Mata S A and Bottjer D J. 2012. Microbes and mass extinctions:Paleoenvironmental distribution of microbialites during times of biotic crisis. Geobiology, 10(1) : 3–24.
DOI:10.1111/j.1472-4669.2011.00305.x ( 0) 0)
|
| [76] |
McMenamin M A S and McMenamin D L S. 1990. The Emergence of Animals:The Cambrian Breakthrough. New York: Columbia University Pres : 1-217.
( 0) 0)
|
| [77] |
McSwain B S, Irvine R L, Hausner M, et al. 2005. Composition and distribution of extracellular polymeric substances in aerobic flocs and granular sludge. Applied and Environmental Microbiology, 71(2) : 1051–1057.
DOI:10.1128/AEM.71.2.1051-1057.2005 ( 0) 0)
|
| [78] |
Meister P, Reyes C, Beaumont W, et al. 2011. Calcium and magnesium-limited dolomite precipitation at Deep Springs Lake,California. Sedimentology, 58(7) : 1810–1830.
DOI:10.1111/sed.2011.58.issue-7 ( 0) 0)
|
| [79] |
Mobberley J M, Ortega M C and Foster J S. 2012. Comparative microbial diversity analyses of modern marine thrombolitic mats by barcoded pyrosequencing. Environmental Microbiology, 14(1) : 82–100.
DOI:10.1111/j.1462-2920.2011.02509.x ( 0) 0)
|
| [80] |
Monty C L V.1976.The origin and development of cryptalgal fabrics.In:Walter M R(Ed.).Stromatolites(Developments in Sedimentology,20).Amsterdam:Elsevier.193—249.
( 0) 0)
|
| [81] |
Peng P, Liu F, Zhai M G, et al. 2012. Age of the Miyun dyke swarm:Constraints on the maximum depositional age of the Changcheng System. Chinese Science Bulletin, 57(1) : 105–110.
DOI:10.1007/s11434-011-4771-x ( 0) 0)
|
| [82] |
Pentecost A. 1985. Association of cyanobacteria with tufa deposits:Identity,enumeration,and nature of the sheath material revealed by histochemistry. Geomicrobiology Journal, 4(3) : 285–298.
DOI:10.1080/01490458509385936 ( 0) 0)
|
| [83] |
Perri E, Tucker M E and Spadafora A. 2012. Carbonate organo-mineral micro- and ultrastructures in sub-fossil stromatolites:Marion lake,South Australia. Geobiology, 10(2) : 105–117.
DOI:10.1111/gbi.2012.10.issue-2 ( 0) 0)
|
| [84] |
Phoenix V R, Konhauser K O and Ferris F G. 2003. Experimental study of iron and silica immobilization by bacteria in mixed Fe-Si systems:Implications for microbial silicification in hot springs. Canadian Journal of Earth Sciences, 40(11) : 1669–1678.
DOI:10.1139/e03-044 ( 0) 0)
|
| [85] |
Pisarevsky S A and Natapov L M. 2003. Siberia and Rodinia. Tectonophysics, 375(1-4) : 221–245.
DOI:10.1016/j.tecto.2003.06.001 ( 0) 0)
|
| [86] |
Reimann B E F, Lewin J C and Volcani B E. 1966. Studies on the biochemistry and fine structure of silica shell formation in diatoms. Ⅱ.The structure of the cell wall of Navicula pelliculosa(Breb)Hilse.Journal of Phycology, 2(2) : 74–84.
( 0) 0)
|
| [87] |
Renaut R, Jones B and Tiercelin J J. 1998. Rapid in situ silicification of microbes at Loburu hot springs,Lake Bogoria,Kenya Rift Valley. Sedimentology, 45(6) : 1083–1103.
DOI:10.1046/j.1365-3091.1998.00194.x ( 0) 0)
|
| [88] |
Riding R. 2000. Microbial carbonates:The geological record of calcified bacterial-algal mats and biofilms. Sedimentology, 47(suppl.1) : 179–214.
( 0) 0)
|
| [89] |
Riding R and Liang L. 2005. Geobiology of microbial carbonates:Metazoan and seawater saturation state influences on secular trends during the Phanerozoic. Palaeogeography,Palaeoclimatology,Palaeoecology, 219(1-2) : 101–115.
DOI:10.1016/j.palaeo.2004.11.018 ( 0) 0)
|
| [90] |
Rogers J J W and Santosh M. 2009. Tectonics and surface effects of the supercontinent Columbia. Gondwana Research, 15(3-4) : 373–380.
DOI:10.1016/j.gr.2008.06.008 ( 0) 0)
|
| [91] |
Schultze-Lam S, Fortin D, Davis B S, et al. 1996. Mineralization of bacterial surfaces. Chemical Geology, 132(1) : 171–181.
( 0) 0)
|
| [92] |
Soudry D and Weissbrod T. 1995. Morphogenesis and facies relationships of thrombolites and siliciclastic stromatolites in a Cambrian tidal sequence(Elat area,southern Israel). Palaeogeography,Palaeoclimatology,Palaeoecology, 114(2-4) : 339–355.
DOI:10.1016/0031-0182(94)00087-O ( 0) 0)
|
| [93] |
Souza-Egipsy V, García Del Cura M A, Ascaso C, et al. 2006. Interaction between calcite and phosphorus in biomineralization processes in tufa carbonates. International Review of Hydrobiology, 91(3) : 222–241.
DOI:10.1002/(ISSN)1522-2632 ( 0) 0)
|
| [94] |
Spadafora A, Perri E, McKenzie J A, et al. 2010. Microbial biomineralization processes forming modern Ca:Mg carbonate stromatolites. Sedimentology, 57(1) : 27–40.
DOI:10.1111/sed.2009.57.issue-1 ( 0) 0)
|
| [95] |
Sprachta S, Camoin G, Golubic S, et al. 2001. Microbialites in a modern lagoonal environment:Nature and distribution,Tikehau atoll(French Polynesia). Palaeogeography,Palaeoclimatology,Palaeoecology, 175(1-4) : 103–124.
DOI:10.1016/S0031-0182(01)00388-1 ( 0) 0)
|
| [96] |
Su W B, Li H K, Huff W D, et al. 2010. SHRIMP U-Pb dating for a K-bentonite bed in the Tieling Formation,North China. China Science Bulletin, 55(29) : 3312–3323.
DOI:10.1007/s11434-010-4007-5 ( 0) 0)
|
| [97] |
Tang D, Shi X and Jiang G. 2013. Mesoproterozoic biogenic thrombolites from the North China platform. International Journal of Earth Sciences, 102(2) : 1–13.
( 0) 0)
|
| [98] |
Trichet J, Défarge C, Tribble J, et al. 2001. Christmas Island lagoonal lakes,models for the deposition of carbonate-evaporite-organic laminated sediments. Sedimentary Geology, 140(1) : 177–189.
( 0) 0)
|
| [99] |
Turner E C, James N P and Narbonne G M. 2000. Taphonomic control on microstructure in Early Neoproterozoic reefal stromatolites and thrombolites. Palaios, 15(2) : 87–111.
DOI:10.1669/0883-1351(2000)015<0087:TCOMIE>2.0.CO;2 ( 0) 0)
|
| [100] |
Turner E C and Jones B. 2005. Microscopic calcite dendrites in cold-water tufa:Implications for nucleation of micrite and cement. Sedimentology, 52(5) : 1043–1066.
DOI:10.1111/sed.2005.52.issue-5 ( 0) 0)
|
| [101] |
Van Lith Y, Warthmann R, Vasconcelos C, et al. 2003. Sulphate-reducing bacteria induce low-temperature Ca-dolomite and high Mg-calcite formation. Geobiology, 1(1) : 71–79.
DOI:10.1046/j.1472-4669.2003.00003.x ( 0) 0)
|
| [102] |
Walter M R and Heys G R. 1985. Links between the rise of the metazoa and the decline of stromatolites. Precambrian Research, 29(1-3) : 149–174.
DOI:10.1016/0301-9268(85)90066-X ( 0) 0)
|
| [103] |
Warthmann R, Van Lith Y, Vasconcelos C, et al. 2000. Bacterially induced dolomite precipitation in anoxic culture experiments. Geology, 28(12) : 1091–1094.
DOI:10.1130/0091-7613(2000)28<1091:BIDPIA>2.0.CO;2 ( 0) 0)
|
| [104] |
Woods A D and Baud A. 2008. Anachronistic facies from a drowned Lower Triassic carbonate platform:Lower member of the Alwa Formation(Ba'id Exotic),Oman Mountains. Sedimentary Geology, 209(1-4) : 1–14.
DOI:10.1016/j.sedgeo.2008.06.002 ( 0) 0)
|
| [105] |
Yee N, Phoenix V R, Konhauser K O, et al. 2003. The effect of cyanobacteria on silica precipitation at neutral pH:Implications for bacterial silicificationin geothermal hot springs. Chemical Geology, 199(1-2) : 83–90.
DOI:10.1016/S0009-2541(03)00120-7 ( 0) 0)
|
| [106] |
Zhao G C, Cawood P A, Wilde S A, et al. 2002. Review of global 2. 1-1.8 Ga orogens:Implications for a pre-Rodinia supercontinent.Earth Science Review, 59(1-4) : 125–162.
( 0) 0)
|
| [107] |
Zhao G C, Sun M, Wilde S A, et al. 2004. A Paleo-Mesoproterozoic supercontinent:Assembly,growth and breakup. Earth-Science Reviews, 67(1-2) : 91–123.
DOI:10.1016/j.earscirev.2004.02.003 ( 0) 0)
|
 2016, Vol. 51
2016, Vol. 51

