聚乙烯醇(PVA)广泛用于纺织、造纸和涂料等行业,纺织工业产生的退浆废水残留大量PVA,造成严重的环境污染。相比于高温碱法,采用PVA生物降解法进行退浆,一方面有利于减少废物排放,另一方面有利于保护织物组织[1-2]。目前报道的PVA生物降解方式主要有两种:一种是PVA氧化酶(SAO)与氧化型PVA水解酶(OPH)组合降解,另一种是PVA脱氢酶(PVADH)与OPH组合降解[3-4]。
目前,已有Pseudomonas sp. VM15C和Sphingopyxis sp. 113P3两个菌株的pvadh基因得到确认[5-6],后者在大肠杆菌和毕赤酵母中表达后酶活分别达到194 U/mL[7]和8 464 U/mL[8],但是在大肠杆菌中易形成包涵体,需进行复杂的包涵体溶解和蛋白复性,而近一半蛋白无法恢复活性[7];在毕赤酵母中则会因为体内蛋白酶的作用发生血红素结构域的切割,无法得到完整的PVADH[8]。成熟的PVADH位于周质空间,属于吡咯喹啉醌(pyrroloquinoline quinone,PQQ)依赖性醌酶,而大肠杆菌和毕赤酵母中生产的PVADH不含辅酶,需要结合其他菌株或人为提供的PQQ才具有催化活性。由于PQQ价格昂贵,增加了PVADH使用的成本,限制了其工业化应用。
作为一种热点工业微生物[9],肺炎克雷伯杆菌(Klebsiella pneumoniae)具有如下优势:(1)含有pqqABCDEF基因簇(简称pqq),能够天然生产辅酶PQQ[10],节省外源添加PQQ的成本[11];(2)作为原核宿主菌,在生产过程中发生蛋白酶切割PVADH的可能性小;(3)发酵成本低,生长快,能高效利用甘油生产1, 3-丙二醇、3-羟基丙酸等大宗化学品[12-13],附加产值高。本文拟采用K. pneumoniae作为PVADH的生产菌株,实现PQQ-PVADH全酶的高效生物合成。
1 实验部分 1.1 材料 1.1.1 菌株与载体K. pneumoniae DSM2026,大肠杆菌E. coli DH5α,表达载体pET-3tac(将pET-28a的T7启动子替换为3个串联的tac启动子),pET-15A-cm(将pET-28a的复制子替换为15A,抗性基因替换为氯霉素(cm)抗性基因),均为本实验室保存。
1.1.2 培养基LB培养基:蛋白胨10 g/L;酵母粉5 g/L;NaCl 10 g/L;pH 7.0。固体培养基添加15 g/L琼脂。
甘油发酵培养基:甘油30 g/L,酵母粉3 g/L,KH2PO41.3 g/L,K2HPO4·3H2O 3.4 g/L,(NH4)2SO4 4.0 g/L,MgSO4·7H2O 0.5 g/L,CaCO3 0.1 g/L,微量元素1.25 mL/L[14]。
抗性培养基中加入50 μg/mL硫酸卡那霉素(kan)或17 μg/mL cm。
1.1.3 主要试剂限制性内切酶和DNA连接酶购买自NEB(北京)有限公司;Taq DNA聚合酶、质粒提取试剂盒、PCR产物回收试剂盒和DNA marker购买自北京博迈德基因技术有限公司;BCA蛋白定量试剂盒购买自北京全式金生物技术有限公司;引物和优化后的pvadh由华大基因(北京)合成。DNA测序由北京睿博兴科生物技术有限公司完成。其余常规化学试剂均为国产分析纯。
1.2 方法 1.2.1 重组菌构建以National Center for Biotechnology Information(NCBI)报道的Sphingopyxis sp. 113P3 pvadh基因序列(GenBank accession No. JQ235753)为模板,使用DNAMAN软件按照K. pneumoniae密码子偏好性优化,并添加EcoR I和Xho I两个酶切位点。将优化后的pvadh与pET-3tac质粒双酶切,经T4连接酶催化连接后,得到重组质粒pET-3tac-pvadh。
待重组质粒转化感受态E. coli DH5α经抗性筛选、菌落PCR验证和测序确认后,将正确的质粒电转至感受态K. pneumoniae DSM2026,得到重组菌Kp(pET-3tac-pvadh)。
为了解决超表达PVADH后PQQ供应不足的问题,构建另一个超表达PQQ的载体。根据GenBank报道的pqq基因序列设计引物,两端引入EcoR I和Hind III酶切位点(表 1),克隆K. pneumoniae的pqq基因簇,PCR反应参数:94 ℃,5 min;94 ℃,40 s;55 ℃,40 s;72 ℃,6 min,30个循环;72 ℃,10 min,16 ℃保存。将PCR产物和质粒pET-15A-cm通过EcoR I和Hind III双酶切,经T4连接酶催化连接后,得到重组质粒pET-15A-cm-pqq,将其转化至E. coli DH5α感受态,抗性筛选得到的单菌落采用pET载体通用上游引物pET-up和pqqB基因下游引物pqqB-R进行菌落PCR验证,经测序确认后,将pET-15A-cm-pqq电转至Kp(pET-3tac-pvadh)中,得到同时超表达pvadh和pqq的双质粒菌株Kp(pvadh+pqq),在含50 μg/mL kan和17 μg/mL cm的LB双抗固体培养基上培养,通过菌落PCR筛选同时含有两个质粒的单菌落。
| 下载CSV 表 1 引物序列 Table 1 Primers used in this study |
菌株活化培养 在含4 mL LB培养基的试管中,按1%接种量(体积分数)加入保存的菌液,37 ℃,200 r/min,恒温震荡培养12 h。
摇瓶发酵培养 在含100 mL发酵培养基的250 mL三角摇瓶中,按1%接种量(体积分数)加入活化后菌液,37 ℃,200 r/min,微氧发酵。接种2 h后,加入0.5 mmol/L(异丙基硫代半乳糖苷)到发酵液中。
数据采集 每3 h取样,测定菌液在600 nm波长处的吸光值A600,24 h后取菌液制备粗酶液,测PVADH酶活。
发酵优化 通过单因素试验依次对甘油添加量、IPTG添加量、IPTG添加时间、发酵温度进行优化。
1.2.3 PVADH粗酶液制备和优化PVADH前体含由25个氨基酸组成的信号肽,在帮助PVADH跨膜之后被切除。成熟的PVADH属于周质蛋白,获得周质蛋白的方法有超声破碎法和渗透休克法[15]。本文对比了两种方法的效果。
(1) 超声破碎法获得PVADH粗酶液摇瓶发酵24 h后,取500 mL发酵液于4 ℃ 12 000 r/min下离心10 min,收集菌体,用PBS缓冲液洗涤1次后重悬于含1 mmol/L蛋白酶抑制剂苯甲基磺酰氟(PMSF)的50 mL PBS缓冲液中。取25 mL重悬液置于50 mL离心管中,冰浴30 min,在冰水保护下进行间歇式超声处理,超声15 s,暂停45 s,反复10次左右,直至菌液变为澄清均质溶液。
(2) 渗透休克法获得PVADH粗酶液500 mL发酵液,离心去上清液,菌体用PBS缓冲液洗涤1次后重悬于50 mL 30%蔗糖溶液中,室温放置10 min,4 ℃离心收集菌体,再重悬于50 mL预冷的5 mmol/L MgSO4溶液中(含1 mmol/L PMSF),吸打混匀后置于冰上20 min,4 ℃离心,得上清液,即周质蛋白溶液。
1.2.4 PVADH酶活性检测参考文献[16]中的方法对PVADH的酶活性进行检测,PVADH酶活定义为酶活检测体系中,每min减少1 nmoL 2, 6-二氯酚靛酚钠(DCIP)(ε=1.91×104 mmol/(L·cm))所需要的酶量为一个活力单位,单位U/mL。
2 结果与讨论 2.1 pvadh密码子的优化及其在K. pneumoniae中的异源表达不同物种对同义密码子的使用具有偏好,利用这一特点,有针对性地进行密码子优化,可帮助外源蛋白高效表达。为此,将Sphingopyxis sp. 113P3的pvadh序列根据K. pneumoniae的密码子偏好性进行优化,优化后的pvadh密码子适应指数(CAI)从0.7提升到0.95,理论上有利于提高蛋白的合成速率和数量。
提取pET-3tac质粒(图 1(a)),与合成的pvadh经EcoR I和Xho I双酶切并连接后,转入E. coli DH5α感受态。菌落PCR采用pET载体的通用引物pET-up与pvadh的下游引物pvadh-XhoI-R,图 1(b)中3号菌株为阳性重组菌。经测序确认后,将质粒pET-3tac-pvadh电转至K. pneumoniae感受态中,经菌落PCR确认(图 1(c)),即得到重组菌Kp(pET-3tac-pvadh)。
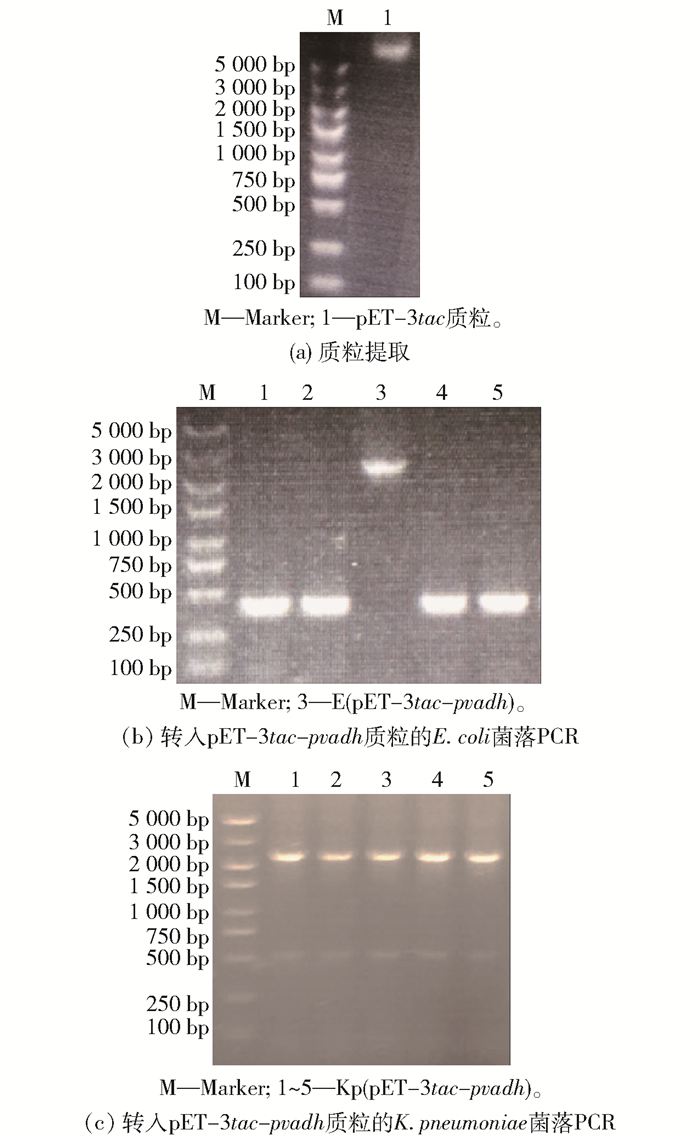
|
图 1 重组菌株Kp(pET-3tac-pvadh)的构建 Fig.1 Construction of the recombinant strain Kp(pET-3tac-pvadh) |
发酵培养Kp(pET-3tac-pvadh),15 h取样作SDS-PAGE蛋白电泳。如图 2所示,重组菌在67 kDa的位置出现特异性条带,符合切除信号肽之后PVADH蛋白的大小,说明实验成功实现了PVADH在K. pneumoniae中的异源表达。
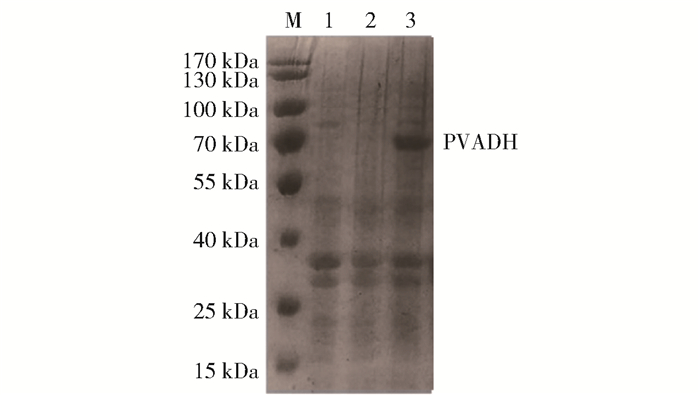
|
M—Marker; 1—K. pneumoniae wild-type (wt); 2—Kp(pET-3tac); 3—Kp(pET-3tac-pvadh)。 图 2 超表达pavdh肺炎克雷伯重组菌的SDS-PAGE蛋白电泳结果 Fig.2 SDS-PAGE analysis of recombinant K. pneumoniae strain overexpressing pavdh |
将渗透休克法和超声破碎法分离PVADH蛋白的效果进行比较(表 2),可以看出,渗透休克法获得粗酶液的总蛋白和酶活都不如超声法,但是因为渗透休克法获得的上清液中主要是周质蛋白,PVADH比活是超声破碎法得到的粗酶液的3.7倍,所以后续选择渗透休克法制备PVADH粗酶液。
| 下载CSV 表 2 渗透休克法和超声破碎法获得PVADH粗酶液的效果比较 Table 2 Characteristics of the PVADH crude enzyme obtained by osmotic shock and ultrasonic fragmentation |
摇瓶发酵Kp(pET-3tac-pvadh),24 h的PVADH酶活为45.47 U/mL(图 3)。前人在K. pneumoniae中超表达可溶性葡萄糖脱氢酶(sGDH)后发现辅酶PQQ不能满足sGDH的需求,额外添加PQQ能明显提升酶活[12]。
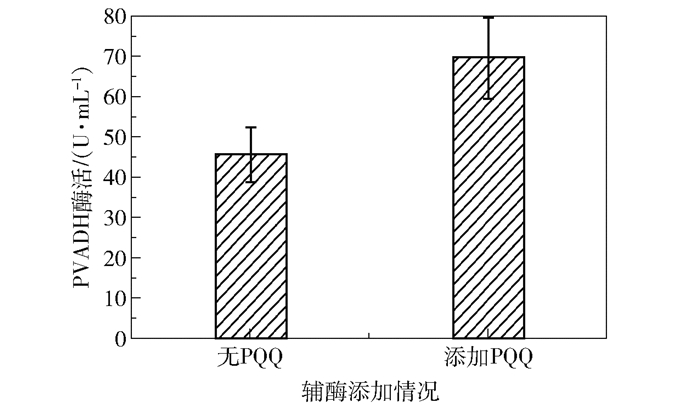
|
图 3 添加或不添加PQQ时PVADH的酶活 Fig.3 PVADH activity with or without PQQ addition |
本文实验也发现,添加6 μmol/L的PQQ有助于提高Kp(pET-3tac-pvadh)酶活,相比不添加PQQ的粗酶液,添加PQQ的粗酶液酶活提高了55.6%(69.6 U/mL),这说明超表达pvadh之后,辅酶PQQ的供给相对不足,所以考虑通过辅酶再生提高Kp(pET-3tac-pvadh)中PQQ产量。为了避免相同复制子在同一宿主中发生质粒不相容问题,采用了本实验室构建的pET-15A-cm载体超表达pqq。提取K. pneumoniae基因组(图 4(a)),克隆pqq(图 4(b)),通过EcoR I和Hind III位点插入pET-15A-cm,获得pET-15A-cm-pqq质粒,将其电转入Kp(pET-3tac-pvadh)感受态中,通过两组菌落PCR分别验证两个质粒的存在:①采用通用上游引物pET-up和pqqB-R验证pET-15A-cm-pqq质粒,正确条带大小为1 500 bp(图 4(c));②采用pET-up与pvadh-xhoI-R验证pET-3tac-pvadh质粒,正确条带大小为2 300 bp(图 4(d))。包含两个质粒的菌株即为Kp(pvadh+pqq)。
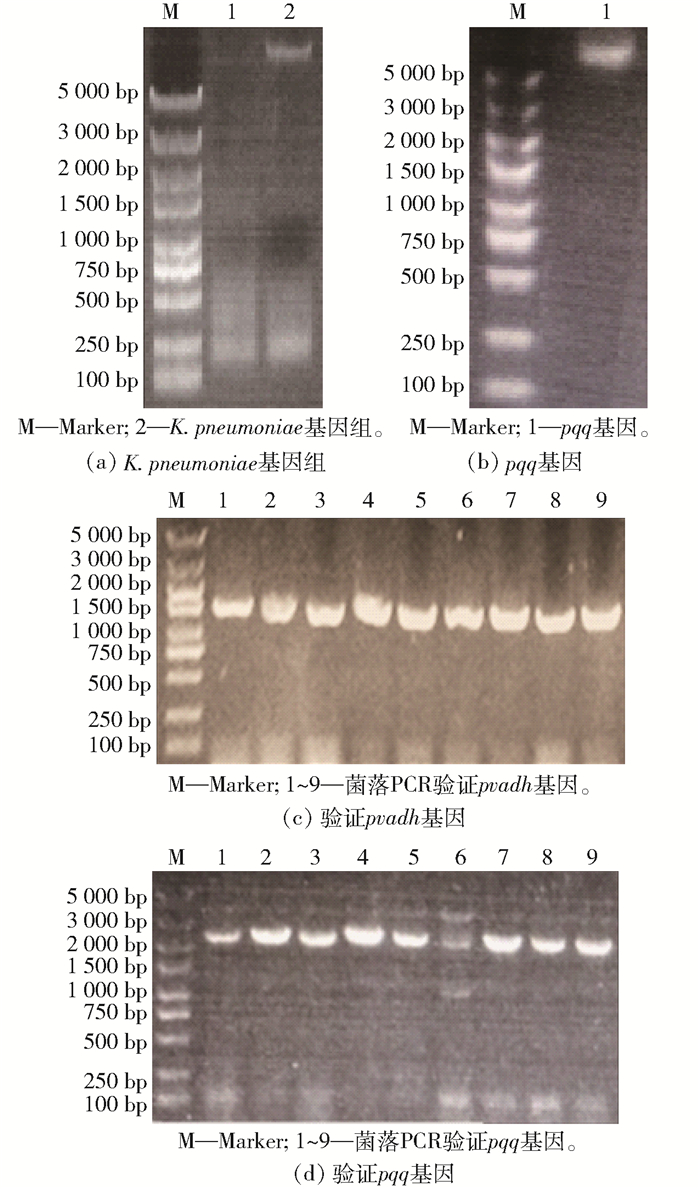
|
图 4 同时超表达pvadh和pqq的K. pneumoniae重组菌构建 Fig.4 Construction of recombinant K. pneumoniae strain coexpressing genes pvadh and pqq |
在摇瓶发酵培养阶段,与野生型K. pneumoniae及Kp(pET-3tac-pvadh)相比,Kp(pvadh+pqq)在开始时显示出明显的生长负荷,但随着时间的延长其生长速度加快,9 h后生物量接近野生型和Kp(pET-3tac-pvadh)(图 5(a))。24 h时检测酶活,发现Kp(pvadh+pqq)的PVADH酶活明显提高,在没有添加PQQ的情况下酶活达到了67.5 U/mL(图 5(b))。以上结果说明辅酶再生很好地满足了PVADH对PQQ的需求。
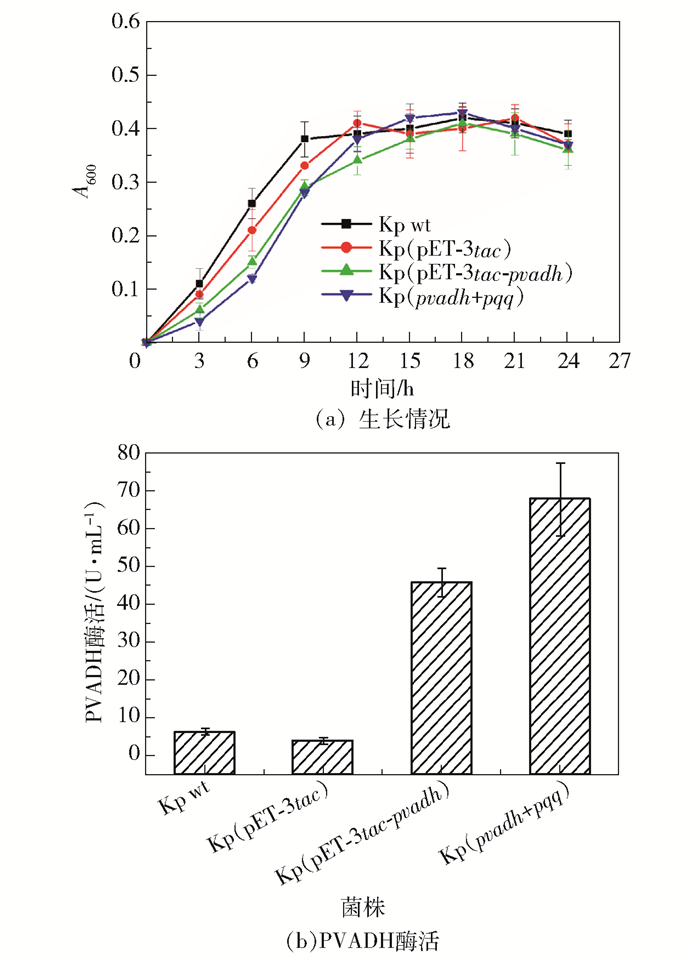
|
图 5 Kp(pET-3tac-pvadh)和Kp(pvadh+pqq)的生长情况与PVADH酶活 Fig.5 Growth and PVADH activities of Kp(pvadh+pqq) and Kp(pET-3tac-pvadh) |
为进一步提高K. pneumoniae中PQQ-PVADH产量,对Kp(pvadh+pqq)的发酵体系进行单因素优化,具体参数包括甘油浓度、IPTG添加量和添加时间及温度。
首先是甘油浓度的优化。K. pneumoniae能高效代谢甘油[13],因此选择甘油作为Kp(pvadh+pqq)的碳源。实验对比了不同甘油浓度对菌体生长和PVADH酶活的影响,结果如图 6所示,发现随着甘油质量浓度从10 g/L升至40 g/L,Kp(pvadh+pqq)的生长量持续攀升,PVADH酶活也随着生物量一同升高;但当甘油质量浓度超过40 g/L后,Kp(pvadh+pqq)的生长量和PVADH酶活不升反降,推测可能是高浓度甘油增加了培养基黏度,影响了菌体生长。
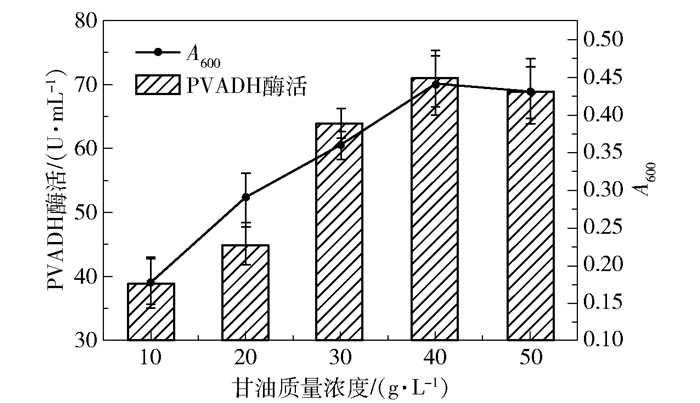
|
图 6 Kp(pvadh+pqq)发酵中甘油浓度的优化 Fig.6 Optimization of glycerol concentration in fermentation of Kp(pvadh+pqq) |
然后是IPTG添加量的优化。构建的两个质粒分别超表达pvadh和pqq,都需要IPTG诱导表达,适度增加IPTG浓度有助于提升两个基因的表达量。从图 7可知,随着IPTG添加量的升高,菌体生物量持续下降,表明IPTG对菌体生长有明显抑制作用;但PVADH的酶活却有明显提升,说明IPTG诱导对pvadh和pqq的高效表达至关重要,结果显示加入0.6 mmol/L IPTG时PVADH酶活最高。
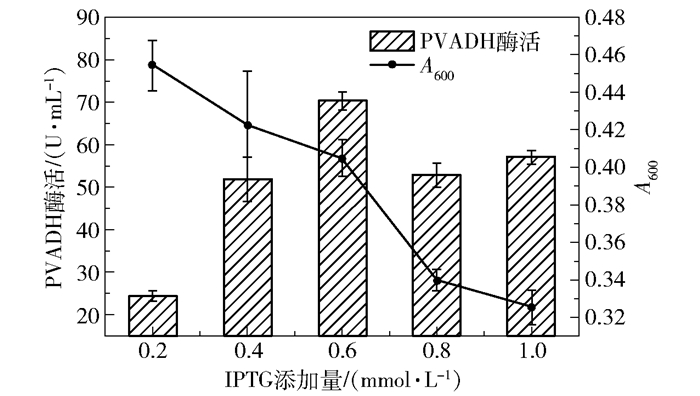
|
图 7 Kp(pvadh+pqq)发酵中IPTG添加量的优化 Fig.7 Optimization of IPTG addition in Kp(pvadh+pqq) fermentation |
之后是诱导剂添加时间的优化。如图 8所示,接种后1 h到3 h,Kp(pvadh+pqq)的生物量A600从0.11缓慢提升到0.67,在A600=0.1~0.4区间内,生物量越大,添加IPTG对24 h后PVADH酶活的提升效果越明显,但当A600达到0.67时添加IPTG,PVADH酶活明显降低,所以选择发酵后2.5 h(A600=0.4)添加IPTG。
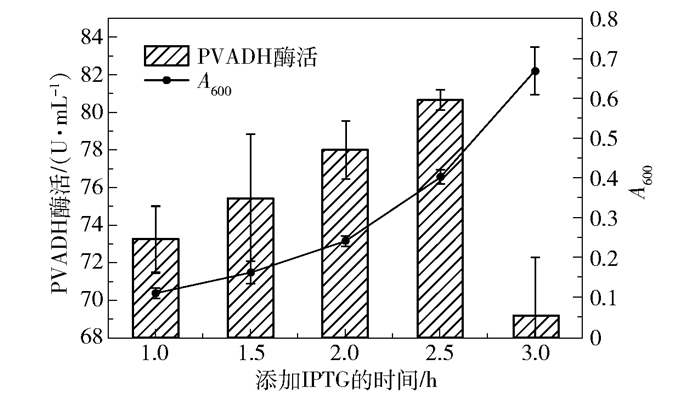
|
图 8 Kp(pvadh+pqq)发酵中IPTG添加时间的优化 Fig.8 Optimization of time to add IPTG in Kp(pvadh+pqq) fermentation |
最后是发酵温度的优化。如图 9所示,随着温度从25 ℃升高到37 ℃,Kp(pvadh+pqq)的生物量和PVADH酶活均有明显提高;但当温度升至42 ℃后,菌体生长严重受阻,生长量和PVADH酶活骤降,所以选择37 ℃作为Kp(pvadh+pqq)的发酵温度。
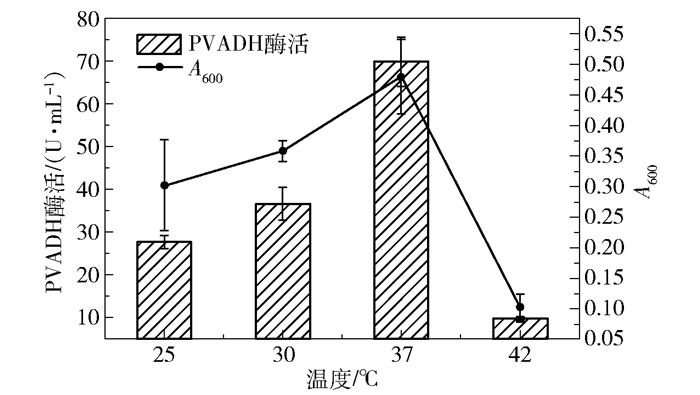
|
图 9 Kp(pvadh+pqq)发酵温度的优化 Fig.9 Optimization of temperature in Kp(pvadh+pqq) fermentation |
综合以上结果,优化后的条件为:40 g/L甘油,37 ℃,2.5 h后添加0.6 mmol/L IPTG进行发酵,24 h时PVADH酶活可达到80.7 U/mL。
3 结论成功在PQQ天然生产菌K. pneumoniae中异源表达了pvadh,通过密码子优化实现了PVADH的高效表达,PVADH酶活达到45.47 U/mL;为解决PQQ供应不足的问题,构建双质粒表达系统同时超表达pqq基因簇,提高宿主菌的PQQ合成量,进一步补充了辅酶PQQ,PVADH酶活达到67.5 U/mL;最后通过发酵条件优化,PVADH酶活达到80.7 U/mL。
目前K. pneumoniae尚未通过基因工程优化其基因组,不具备商业化底盘微生物如E. coli和P. pastoris在基因表达方面的优势,因此其PVADH产量相对较低。但作为一种PQQ天然生产菌,K. pneumoniae在生产PVADH的同时节省了添加辅酶PQQ的高昂成本,为PQQ-PVADH的生产提供了另一个选择方案。随着K. pneumoniae表达体系的不断优化,PQQ-PVADH产量还将进一步提升。
| [1] |
张洁, 王强, 范雪荣, 等. 棉织物的复合酶退浆工艺[J]. 印染, 2016(15): 1-5. ZHANG J, WANG Q, FAN X R, et al. Desizing process of cotton fabric by compound enzymes[J]. Printing and Finishing, 2016(15): 1-5. (in Chinese) |
| [2] |
DU G C, LIU L M, SONG Z X, et al. Production of polyvinyl alcohol-degrading enzyme with Janthinobacterium sp. and its application in cotton fabric desizing[J]. Biotechnology Journal, 2007, 2(6): 752-758. DOI:10.1002/biot.200600121 |
| [3] |
KAWAI F, HU X P. Biochemistry of microbial polyvinyl alcohol degradation[J]. Appl Microbiol Biotechnol, 2009, 84(2): 227-237. DOI:10.1007/s00253-009-2113-6 |
| [4] |
SAKAI K, HAMADA N, WATANABE Y. Degradation mechanism of poly(vinyl alcohol) by successive reactions of secondary alcohol oxidase and β-diketone hydrolase from Pseudomonas sp.[J]. Agricultural and Biological Chemistry, 1986, 50(4): 989-996. |
| [5] |
HU X P, MAMOTO R, FUJIOKA Y, et al. The pva operon is located on the megaplasmid of Sphingopyxis sp. strain 113P3 and is constitutively expressed, although expression is enhanced by PVA[J]. Applied Microbiology & Biotechnology, 2008, 78(4): 685-693. |
| [6] |
SHIMAO M, TAMOGAMI T, KISHIDA S, et al. The gene pvaB encodes oxidized polyvinyl alcohol hydrolase of Pseudomonas sp. strain VM15C and forms an operon with the polyvinyl alcohol dehydrogenase gene pvaA[J]. Microbiology, 2000, 146(3): 649-657. DOI:10.1099/00221287-146-3-649 |
| [7] |
JIA D X, YANG Y, PENG Z C, et al. High efficiency preparation and characterization of intact poly(vinyl alcohol) dehydrogenase from Sphingopyxis sp. 113P3 in Escherichia coli by inclusion bodies renaturation[J]. Applied Biochemistry & Biotechnology, 2014, 172(5): 2540-2551. |
| [8] |
JIA D X, LIU L, WANG H L, et al. Overproduction of a truncated poly (vinyl alcohol) dehydrogenase in recombinant Pichia pastoris by low-temperature induction strategy and related mechanism analysis[J]. Bioprocess Biosyst Eng, 2013, 36(8): 1095-1103. DOI:10.1007/s00449-012-0863-5 |
| [9] |
KUMAR V, PARK S. Potential and limitations of Klebsiella pneumoniae as a microbial cell factory utilizing glycerol as the carbon source[J]. Biotechnology Advances, 2017, 36(1): 150-167. |
| [10] |
MEULENBERG J J M, SELLINK E, RIEGMAN N H, et al. Nucleotide sequence and structure of the Klebsiella pneumoniae pqq operon[J]. Mol Gen Genet, 1992, 232(2): 284-294. |
| [11] |
KOJIMA K, WITARTO A B, SODE K. The production of soluble pyrroloquinoline quinone glucose dehydrogenase by Klebsiella pneumoniae, the alternative host of PQQ enzymes[J]. Biotechnology Letters, 2000, 22(16): 1343-1347. DOI:10.1023/A:1005615400089 |
| [12] |
LEE J H, JUNG M Y, OH M K. High-yield production of 1, 3-propanediol from glycerol by metabolically engineered Klebsiella pneumoniae[J]. Biotechnology for Biofuels, 2018, 11(1): 104. |
| [13] |
JIANG J Q, HUANG B, WU H, et al. Efficient 3-hydroxypropionic acid production from glycerol by metabolically engineered Klebsiella pneumoniae[J]. Bioresources & Bioprocessing, 2018, 5(1): 34. |
| [14] |
WANG J X, ZHAO P, LI Y, et al. Engineering CRISPR interference system in Klebsiella pneumoniae for attenuating lactic acid synthesis[J]. Microbial Cell Factories, 2018, 17(1): 56. DOI:10.1186/s12934-018-0903-1 |
| [15] |
CHEN Y C, CHEN L A, CHEN S J, et al. A modified osmotic shock for periplasmic release of a recombinant creatinase from Escherichia coli[J]. Biochemical Engineering Journal, 2004, 19(3): 211-215. DOI:10.1016/j.bej.2004.03.001 |
| [16] |
HIROTA-MAMOTO R, NAGAI R, TACHIBANA S, et al. Cloning and expression of the gene for periplasmic poly(vinyl alcohol) dehydrogenase from Sphingomonas sp. strain 113P3, a novel-type quinohaemoprotein alcohol dehydrogenase[J]. Microbiology, 2006, 152(7): 1941-1949. DOI:10.1099/mic.0.28848-0 |








