废弃菌棒是指种植食用菌后剩下的废弃物。中国作为世界上排名第一的食用菌生产及消费大国,每年都会产生几百万吨废弃菌棒[1]。菌棒中的主要成分是棉籽壳、木屑、玉米芯等,这些物质含有丰富的半纤维素、纤维素和木质素[2-3]。在种植过程中,食用菌一般主要消耗半纤维素,所以废弃菌棒中含有大量剩余的纤维素和木质素,具有较大的利用空间。然而,当前对废弃菌棒的处理方式主要是焚烧和丢弃田间,这种做法不仅浪费了资源,还会引起环境问题[4-5]。所以,如何有效地利用废弃菌棒具有重要的经济和社会意义。
目前对于废弃菌棒的资源化利用主要有以下几种思路:(1)代替新鲜材料种植食用菌[6];(2)作为有机肥料,有效改善土壤结构和增加土壤肥力[7];(3)废弃菌棒中含有大量未完全分解的木屑,具有较高的热值,有作为燃料用以燃烧的潜能[8];(4)废弃菌棒中含有大量菌丝蛋白、氨基酸等对动物生长有利的物质, 可作为禽畜饲料[9];(5)作为种植基质,废弃菌棒疏松的结构以及其中残留的营养物质均有利于植物的生长[10];(6)作为生态修复材料,可用作生物活性材料,修复土壤及水体污染[11]。这些方法虽然在一定程度上实现了废弃菌棒的再利用,但由于技术不成熟、操作复杂、成本高等原因使其应用受到限制。
生物质热解是在高温无氧条件下将生物质中大分子分解为小分子的技术。由于污染少、产品种类丰富、利用程度高,生物质热解技术成为生物质资源化利用的主要技术之一。热解产物可分为气、液、固三相,分别对应于热解气、焦油和生物炭。生物炭是一种多功能材料,具有较大的比表面积且表面含有较多的活性基团,可以吸附土壤或污水中的重金属和有机污染物等。尽管含碳基质都可用于制备生物炭,但是出于资源化利用有机废物及减少环境污染的目的,如何利用有机废弃物、实现固废资源化成为近年来主要的研究方向。关于生物质的热解反应国内外学者已进行了详尽的探讨[12-14],但是对于废弃菌棒的热解却鲜有报道。
本文以废弃菌棒为原料,采用高温管式炉对其进行热解,探究废弃菌棒在热解过程中的产气、产油和产炭规律,通过对气体组分、热解炭热值、热解炭结构等进行表征,提出热解产物作为气体燃料和固体燃料等方面的应用可能;并选择适当条件下的热解炭作为原料,探究不同活化条件对其制备的活性炭吸附性能的影响,选出吸附能力最优的活性炭进行表征及测试,探究其应用潜力,从而实现废弃菌棒的资源化利用。
1 材料与方法 1.1 原料与试剂废弃菌棒,取自河北承德平泉县。将废弃菌棒置于鼓风干燥箱中,在105℃下干燥24h,达到恒重后粉碎至0.425nm以下,待用。废弃菌棒及新鲜菌棒的工业分析和纤维素含量测定结果如表 1所示。
| 下载CSV 表 1 废弃菌棒及新鲜菌棒的工业分析及纤维素含量分析结果 Table 1 Proximate and cellulose content determination of edible fungi residue and fresh bacteria stick |
从表 1中可以看出,由于食用菌生长过程消耗菌棒中的有机质,从而导致废弃菌棒中灰分含量较高,而挥发分和固定碳含量较低。与新鲜菌棒相比,废弃菌棒中半纤维素含量大幅度降低,这主要是由于食用菌生长首先消耗半纤维素,其次消耗纤维素,而基本不消耗木质素[15],导致废弃菌棒中半纤维素含量极低,而纤维素和木质素得到富集。较高的纤维素和木质素含量有利于热解过程中成炭,从而得到较高的炭产量及高品质的炭[16]。
氢氧化钾,盐酸,亚甲基蓝,北京化工厂;碘,天津市化学试剂三厂;碘化钾,天津市光复科技发展有限公司;硫代硫酸钠,天津市大茂化学试剂厂;淀粉,天津市光复精细化工研究所。以上药品均为分析纯,实验用水均为去离子水。
1.2 制备方法 1.2.1 热解炭取50~100g干燥后的废弃菌棒放入高温管式炉中热解,以氮气作为保护气,以20℃/min的升温速率从室温升至不同的热解终温(400℃、500℃、600℃、700℃、800℃、900℃),并在此温度下保持1h。反应完成后将反应器温度降至室温,收集床内固体产物,即热解炭。
1.2.2 活性炭以KOH为活化剂,将热解温度600℃、升温速率20℃/min、热解反应时间1h下制备的热解炭与KOH以不同的碱炭比(mKOH :mC=2 :1、1.5 :1、1 :1、1 :1.5、1 :2)在去离子水中混合后,在37℃恒温摇床中浸渍24h。将浸渍后的样品在105℃烘箱中干燥至恒重,待用。称取一定量的浸渍炭置于灰皿中,在高温管式炉中活化,探究不同碱炭比、不同活化时间(0.5h、1h、1.5h、2h)、不同活化温度(500℃、600℃、700℃、800℃、900℃)下活性炭的特性差异。将活化后的炭用去离子水浸泡24h后,加盐酸调节pH至2,浸泡24h,去除可溶于酸的杂质。将混合液置于电磁搅拌加热器上煮沸0.5h后趁热过滤,并用去离子水洗涤至滤液为中性。将过滤后的活性炭在105℃烘箱中干燥至恒重。
1.3 分析方法生物质原料样品的工业分析按照GB/T 28731—2012《固定生物质燃料工业分析方法》测定,其中测定的水分、灰分、挥发分、固定碳含量均为空气干燥基含量。废弃菌棒及新鲜菌棒中木质纤维素含量按照范氏组分分析法采用Ankom 200 0- Ⅰ纤维素测定仪(ANKOM Technology公司)测定。
将不同温度下制得的热解炭干燥粉碎至0.15nm以下,采用vario EL cube型有机元素分析测试仪(德国Elementar公司)检测其中的C、H、N、S元素含量。采用D Y- ZDH W- 6型微机全自动量热仪(鹤壁大宇仪器仪表有限公司)对不同温度下所得热解炭的热值进行测定。采用Agilent 7890A型气相色谱仪(美国安捷伦科技公司)测定气相产物中H2、CO、CH4、CO2的体积分数。使用S- 4700型扫描电子显微镜(日本日立公司)对热解炭及活性炭的表面微观结构进行观察。另外使用TGA/DSC1/1100SF型热重分析仪(瑞士Mettler Tolerdo公司)对600℃下热解炭的热重曲线进行测定,加热范围为室温到1000℃,升温速率10、20、30℃/min,氮气流速50mL/min。
分别按照GB/T 12496.10—1999《木制活性炭检验方法亚甲基蓝脱色力》和GB/T 12496.8—1999《木质活性炭试验方法碘吸附值的测定》测定活性炭亚甲基蓝的吸附值和碘值。活性炭的比表面积采用QUADRASORB SI全自动比表面积和孔隙度分析仪(美国康达公司),于180℃脱气10h去除杂质后测量。
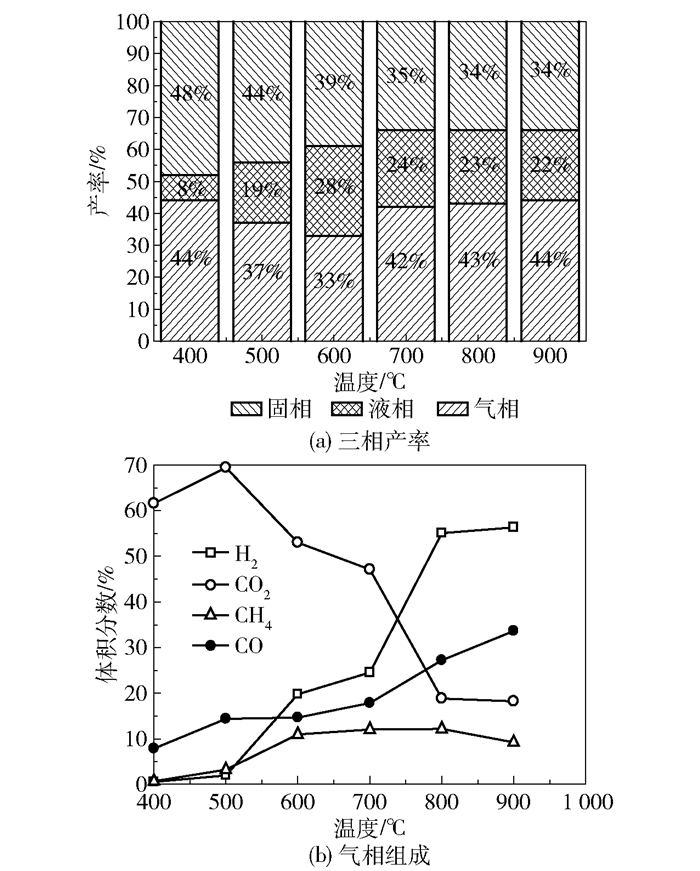
2 结果与讨论 2.1 废弃菌棒热解条件的优化与结构表征 2.1.1 热解终温对热解效果的影响图 1(a)、(b)分别为热解终温对热解的三相产率及气相组成的影响。如图 1(a)所示,热解炭的产率随着热解温度的升高而降低,在温度超过700℃后下降趋势减缓。这是由于随着温度的上升,废弃菌棒中的可挥发成分析出,导致固相产物产率下降;在较高温度时,固相产物中的可挥发物质已基本脱出,此时产率的下降主要来自碳和气体的反应,因而趋势变缓。
|
图 1 不同热解温度下的三相产率及气相组成 Fig.1 Effect of pyrolysis temperature on productivity and gas composition |
与热解炭产率变化趋势不同的是,焦油产率在低于600℃时随着温度的上升而升高,但当温度继续上升,焦油的产率反而降低。焦油是生物质气化过程中可凝结烃类的有机混合物,组分相对复杂[17-18]。目前大多数学者认为,在一定的温度范围内,焦油的产量随温度升高而升高,升至峰值后(约650℃),随着温度的升高转而下降[19-20],这与本文实验中高温时检测到的数据一致。因此,我们认为在废弃菌棒的热解过程中,随着温度升高至600℃,生物质中的可凝结烃类不断地析出,碳化程度增加,焦油产率也随之升高。当温度高于600℃时,随着温度的升高,低温下生成的一级焦油组分会发生变化,含氧化合物逐步脱氧生成多环芳烃类物质,焦油的产率也随之降低[21-22]。
与焦油产率相对应,气相产物产率在400~600℃随着温度的升高而减小,温度高于600℃后,又随着温度的升高而增大,最后趋于平衡。图 1(b)是气相组成中各组分的含量变化,可以看到,CO2含量随温度呈现先上升后快速下降的趋势。这是由于低温时CO2还原反应速率慢,从固相析出CO2的速率和焦油裂解产生CO2的速率大于CO2转化的速率,所以CO2含量有所升高;随着温度升高,CO2还原反应的速率加快,导致其含量快速下降。而H2的含量始终随着温度的升高而升高,这是因为在500~600℃时发生的水蒸气还原反应(C+H2O→ CO+H2)和在700~800℃时发生的一氧化碳变换反应(CO+H2O→ CO2+H2)增加了H2的含量。CO的含量随着热解终温上升而上升,但是幅度不大,这主要是因为CO2还原产生CO的同时,CO变换反应也在消耗CO,使得CO含量虽然在不断上升,但趋势平缓。甲烷含量随着热解终温的上升呈现先上升后下降的趋势,这是由于低于800℃时主要发生的是甲烷化反应,甲烷含量随着反应的进行增加,而当高于800℃时发生的蒸汽重整反应(CH4+H2O→CO+3H2)导致甲烷含量略有下降。
2.1.2 不同温度下制备的热解炭的表征分析结果对不同温度下制得热解炭的元素分析结果见表 2。可以看出,与热解前相比,各个温度下的热解炭中C含量增加,H含量减少,这说明热解是一个C富集、H析出的过程。同时可以看到,C含量并不是呈现单一的上升或下降趋势,这是由于随着热解终温的变化,各种反应的主次发生变化。在温度较低时,碳参加水蒸气还原反应、二氧化碳还原反应及甲烷化反应,导致固相中的C含量减少,但随着热解终温的升高,焦油和气体的析出完全,C含量又有所上升。另外,从表 2中可以看出,与废弃菌棒相比,热解之后热解炭的热值均有所提高(在17.11~22.86 MJ/kg之间),且与应用普遍的稻秆热解炭(17.9 MJ/kg)[23]相比也有较优的表现,说明菌棒热解炭具有进一步利用的潜力。
| 下载CSV 表 2 废弃菌棒及不同温度下制备的热解炭的元素分析结果 Table 2 Elemental analysis and calorific value of edible fungi residue and biochar |
不同温度下制得热解炭的SEM图像如图 2所示。从图 2(a)中可以看到管状纤维结构,说明热解终温为400℃时废弃菌棒的热解尚不充分,仍保留了部分生物质原本的结构。当热解终温为500℃时,管壁表面开始凹陷,这是由于随着温度的上升,热解更加充分,生物质原本的结构遭到破坏。当热解终温为600℃时,炭形貌已经明显,孔隙结构开始形成。从图 2(d)中可以看到终温为700℃时的热解炭上有明显的孔结构。当热解终温继续上升,随着热解的进行,孔隙结构坍塌,材料出现团聚。

|
图 2 不同温度下热解炭的SEM图 Fig.2 SEM images of biochar prepared at different temperatures |
综合以上炭产率、气体成分组成、热值及孔结构的变化,我们认为600℃时,生物质已基本完全碳化,可析出烃类物质完全脱出且孔隙并未因高温产生塌陷,结构相对完整。考虑到活化过程中活化剂的浸入、经济效益以及炭材料的再造孔潜力,选择终温600℃的生物质炭作为下一步活化的原料,既较大程度地优化了性能,又降低了能量的消耗。
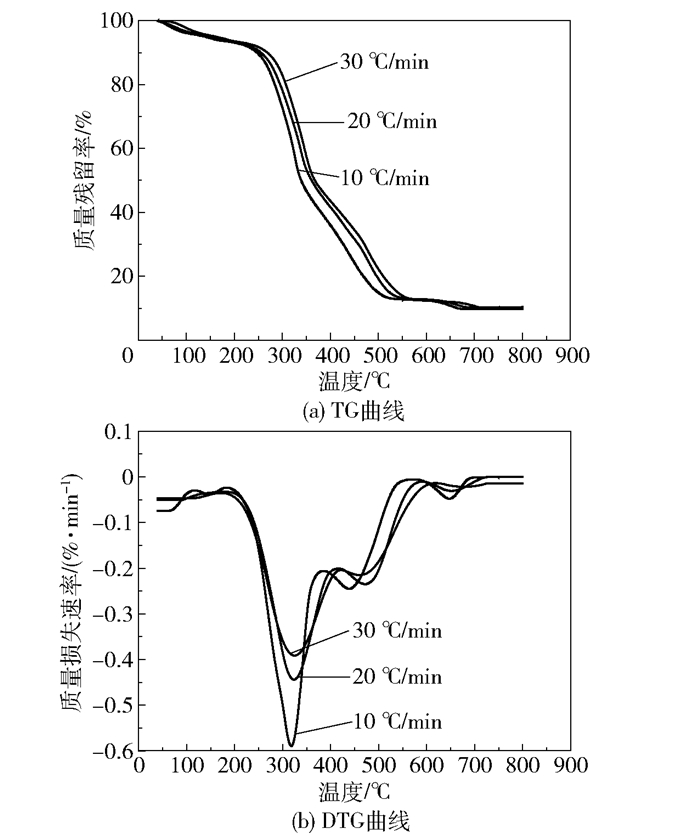
图 3(a)、(b)分别为600℃下所得热解炭在不同升温速率下的TG和DTG曲线。由图 3(a)可见,随着升温速率的提高,曲线向右侧移动,说明要达到相同的失重率需要更高的温度。这主要是由于热解速率的加快导致了挥发分在内部的滞留,阻碍了热解过程的进行。
|
图 3 600℃热解炭在不同升温速率下的热重分析曲线 Fig.3 TG and DTG curves (recorded with different heating rates) of biochar prepared at 600℃ |
由图 3(b)可见,随着升温速率的提高,失重速率增大,且峰值温度右移(10、20、30℃/min的升温速率下峰值温度分别为317.8、323.3、325.0℃),主反应面积明显降低。主要原因是终温一致时,升温速率越大意味着热解时间越短,程度越低;此外过快的升温速率也阻碍了测点、试样间的传热,从而导致热滞后加重[24]。
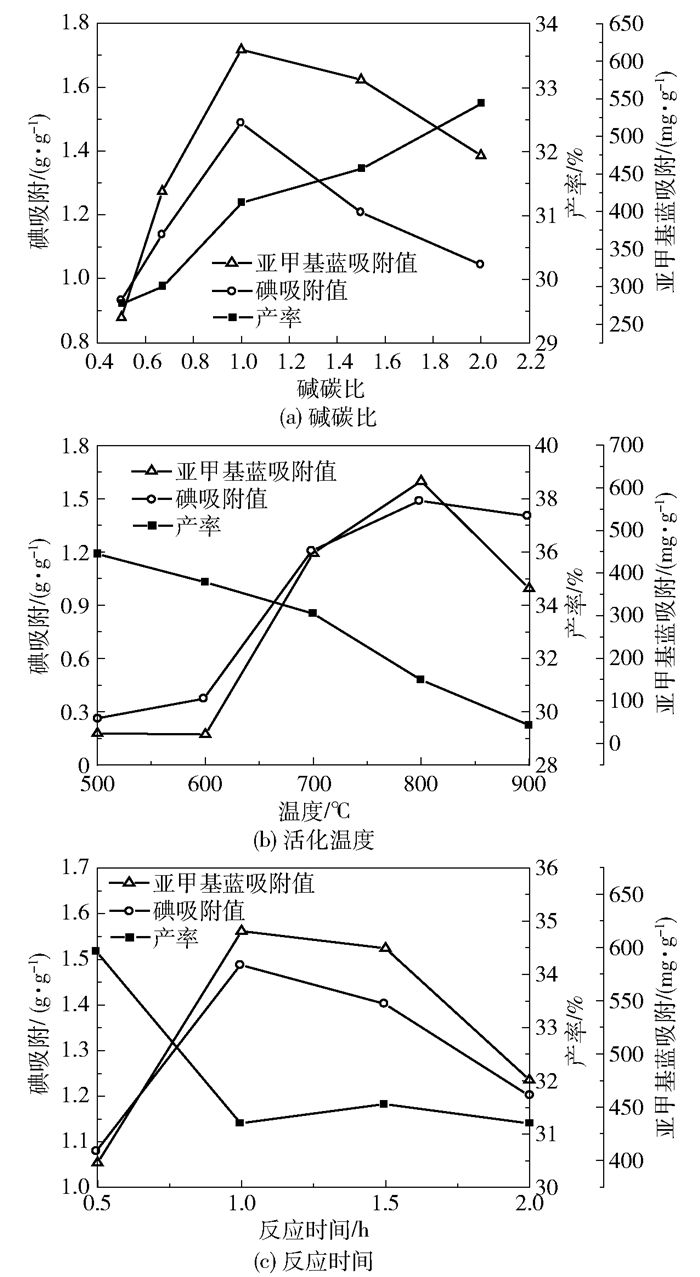
2.2 热解炭的活化条件优化与结构表征 2.2.1 不同活化条件对活性炭产率及吸附能力的影响在活化温度800℃、活化时间1h的实验条件下,探究活性炭产率及其吸附能力随碱碳比的变化,结果如图 4(a)所示。随着碱碳比的增大,碘和亚甲基蓝的吸附值呈现先增大后减小的趋势,在碱碳比为1.0时达到峰值(分别为1563.90mg/g和615.32mg/g)。当碱碳比较低时,随着其值的升高,更多的KOH分解生成K2O和水蒸气,同时炭在高温下与水反应生成气体,导致了孔隙的形成与增多。当碱碳比超过一定值后,孔结构被烧毁塌陷,反而降低了活性炭的比表面积和吸附能力[25]。
|
图 4 不同活化条件对活性炭性能的影响 Fig.4 Effect of different conditions on the yield and adsorption capacity of activated carbon |
活化温度对活性炭产率及其吸附能力的影响如图 4(b)所示。随着温度的升高,活性炭产率下降。这是由于温度越高,炭在与水的反应中被消耗得越多,因此产率降低。而随着活化温度的升高,活性炭对色素的吸附值先增大后减小。主要原因是在较低温度时,KOH与炭的反应速率都较低,孔结构尚未完全生成,吸附能力较低。随着温度升高,其中易挥发组分的扩散促进了活性炭孔结构的生成。当达到金属钾的沸点(762℃)以后,大量钾原子涌入到各个孔隙和层间,从而形成更加合理且丰富的孔结构[26],因此活性炭对碘和亚甲基蓝的吸附能力明显增强。但当活化温度达到900℃时,由于活化反应速率过大,大量气体的生成以及高温产生的过度烧蚀反而破坏了材料的结构分布,使其吸附值降低。
活性炭产率及其吸附能力随活化时间的变化如图 4(c)所示。可以看出,产率随着反应时间先降低而后趋于稳定,而活性炭的吸附能力随着活化时间先增强后减弱。这是因为当活化时间小于1h时,活性炭活化不完全,产率较低。当活化程度随着时间而增加时,孔结构逐步形成,吸附能力增强,并在1h时活化达到完全。当活化时间超过1h后,活性炭被过度烧蚀,导致孔隙塌陷,吸附能力减弱。
根据以上实验结果,利用菌棒热解炭为原料制备活性炭的最佳实验条件为:活化温度800℃,碱碳比1.0,活化时间1h。在此条件下制得活性炭的碘吸附值为1563.90mg/g,亚甲基蓝吸附值为615.32mg/g,产率为31.2%。鉴于商用活性炭的碘吸附值约为1000mg/g,亚甲基蓝吸附值为100~180mg/g,可见本文由菌棒制备的活性炭具有较强的吸附能力,因此有较大的市场应用潜力,故将此最佳条件下制得的活性炭进行进一步的结构表征。
2.2.2 最佳条件下制得活性炭的表征结果在最佳条件下制备的活性炭的电镜照片如图 5所示。与热解炭的电镜照片(图 2)对比可以发现,活性炭的孔隙结构大大增加,说明吸附能力大幅度提升,与2.2.1节中的吸附结果相一致。

|
图 5 最佳条件下制备活性炭的电镜图像 Fig.5 SEM image of activated carbon prepared under the optimum condition |
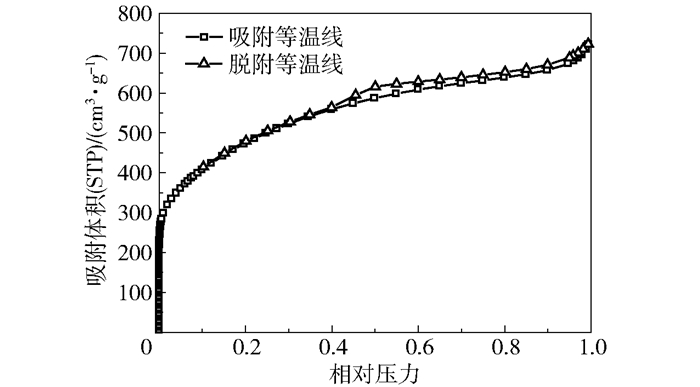
最佳条件下制备的活性炭样品N2吸附-脱附等温线如图 6所示。可以看出,等温线在较高气压下呈现出较为平缓的趋势,说明该等温线为国际纯粹化学与应用化学联合会(IUPAC)规定的Ⅰ型特征。当相对压力高于0.1时,吸附等温线缓慢地上升,表明样品具有微孔结构,吸附容量受孔体积影响较大。在相对压力约为0.1时,吸附等温线出现转折,对应于样品的微孔被完全充满[27]。同时,吸附和脱附曲线所形成的滞后回线表明了中孔的存在[28]。由氮气吸附-脱附等温线可以进一步分析材料的孔结构特征,结果列于表 3。
|
图 6 最佳条件下制备活性炭的氮气吸附-脱附等温线 Fig.6 Adsorption and desorption isotherms of activated carbon prepared under the optimum conditions |
| 下载CSV 表 3 最佳条件下制备活性炭的孔隙特征 Table 3 Textural characteristics of EF R- AC prepared under the optimum conditions |
孔径分布(PSD)是吸附剂的一个重要的特性。根据IUPAC的分类,吸附孔分为3类,即微孔(<2 nm)、中孔(2~50 nm)和大孔(>50 nm)。图 7(a)和(b)是根据密度函数理论模型(DFT)得到的材料孔径分布图。从图 7可以看到,最佳条件下制得的活性炭中主要存在微孔和中孔,而大孔的分布相对较少,这与样品N2吸附-脱附等温线得到的结论一致。表 3是该样品测得的孔隙特征,可以看到材料具有较高的BET表面积(1 659.81 m2/g)和总孔体积(1.11 mL/g),微孔表面积和体积则相对较小,这进一步说明了材料中含有大量的介孔,并具有良好的孔径分布[29-31]。吸附剂吸附水中有机物的过程大致包括3个步骤:①水相中的有机物扩散至吸附材料的外表面;②有机物在吸附材料孔隙内的扩散;③有机物在孔隙内表面的吸附反应[30]。因此良好的孔径分布可以使材料更加有效地吸附水中的有机污染物,这也是活化后的碳材料具有良好吸附能力的原因。
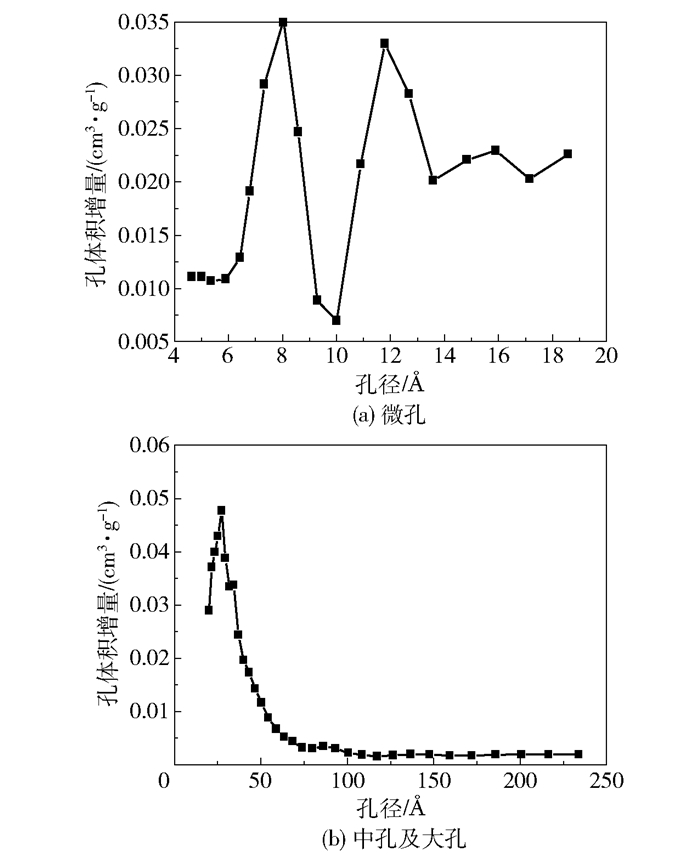
|
图 7 最佳条件下制备的活性炭孔径分布 Fig.7 Pore size distribution of activated carbon prepared under the optimum conditions |
(1) 以废弃菌棒为原料,在高温热解条件下制得生物质炭,结果表明温度越高越有利于富氢燃气的产生。热解温度为900℃、升温速率20℃/min、热解反应时间为1h时的气体产量最大,其中H2占55.55%、CO占31.93%、CH4占8.52%。同时,随着温度的上升,生物质炭原本的结构被破坏,孔隙结构初步产生,这为活化过程中KOH进入热解炭内部造孔创造了有利条件,有利于获得高比表面积的活性炭。
(2) 在活化温度800℃、碱碳比1.0、活化时间1h的条件下制得活性炭的吸附能力最强,其亚甲基蓝吸附值为615.32mg/g、碘吸附值为1563.90mg/g、比表面积为1659.81m2/g,超过普通商业活性炭标准,具有较大的利用价值。
| [1] |
邹德勋, 潘斯亮, 黄芳, 等. 菌糠资源化技术[J]. 北方园艺, 2010(19): 182-185. ZOU D X, PAN S L, HUANG F, et al. Resource recycling technology of spent mushroom substrate[J]. Northern Horticulture, 2010(19): 182-185. (in Chinese) |
| [2] |
毛进祥, 杨环高, 陈刘杰. 食用菌菌渣利用研究现状[J]. 农业开发与装备, 2014(7): 54. MAO J X, YANG H G, CHEN L J. Research status of utilization of edible mushroom residue[J]. Agricultural Development & Equipments, 2014(7): 54. (in Chinese) |
| [3] |
蔡晓旭.废弃蘑菇培养基活性炭的制备、吸附及再生研究[D].北京: 北京林业大学, 2015. CAI X X. Preparation of activated carbon from waste mushroom culture medium and study of its adsorption and regeneration[D]. Beijing: Beijing Forestry University, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10022-1015320220.htm |
| [4] |
BRIDGWATER A V. Review of fast pyrolysis of biomass and product upgrading[J]. Biomass & Bioenergy, 2012, 38(2): 68-94. |
| [5] |
董雪梅, 王延锋, 孙靖轩, 等. 食用菌菌渣综合利用研究进展[J]. 中国食用菌, 2013, 32(6): 4-6. DONG X M, WANG Y F, SUN J X, et al. Research on utilization of edible fungi residue[J]. Edible Fungi of China, 2013, 32(6): 4-6. (in Chinese) |
| [6] |
王金贺, 王延锋, 孙靖轩, 等. 不同比例的黑木耳菌糠提取液对五种蘑菇菌丝生长的影响[J]. 北方园艺, 2013(4): 156-158. WANG J H, WANG Y F, SUN J X, et al. Effects of different proportion of waste material of auricularia auricula on the mycelium growth of five edible fungi[J]. Northern Horticulture, 2013(4): 156-158. (in Chinese) |
| [7] |
吴富强, 李英梅, 卫拯友, 等. 葛根菌糠生物有机肥在温室蔬菜上的应用效果研究[J]. 陕西农业科学, 2009, 55(6): 61-63. WU F Q, LI Y M, WEI Z Y, et al. Study on the application of pueraria residue bio-fertilizer on greenhouse vegetables[J]. Shaanxi Journal of Agricultural Science, 2009, 55(6): 61-63. (in Chinese) DOI:10.3969/j.issn.0488-5368.2009.06.026 |
| [8] |
高士友, 周绪元. 黑木耳菌糠综合利用技术的研究[J]. 中国果菜, 2010(10): 55-57. GAO S Y, ZHOU X Y. Study on comprehensive utilization technology of auricularia fungus[J]. China Fruit Vegetable, 2010(10): 55-57. (in Chinese) DOI:10.3969/j.issn.1008-1038.2010.10.026 |
| [9] |
叶红英, 张宗庆, 肖明举, 等. 菌糠饲料饲喂可乐育肥猪的试验[J]. 饲料研究, 2011(3): 81-82. YE H Y, ZHANG Z Q, XIAO M J, et al. Experiments of feeding coke pigs with fungus feed[J]. Feed Research, 2011(3): 81-82. (in Chinese) |
| [10] |
MEDINA E, PAREDES C, PÉREZ-MURCIA M D, et al. Spent mushroom substrates as component of growing media for germination and growth of horticultural plants[J]. Bioresource Technology, 2009, 100(18): 4227-4232. |
| [11] |
LAU K L, TSANG Y Y, CHIU S W. Use of spent mushroom compost to bioremediate PAH-contaminated samples[J]. Chemosphere, 2003, 52(9): 1539-1546. DOI:10.1016/S0045-6535(03)00493-4 |
| [12] |
BLASI C D. Modeling chemical and physical processes of wood and biomass pyrolysis[J]. Progress in Energy and Combustion Science, 2008, 34(1): 47-90. DOI:10.1016/j.pecs.2006.12.001 |
| [13] |
RAVEENDRAN K, GANESH A, KHILAR K C. Influence of mineral matter on biomass pyrolysis characteristics[J]. Fuel, 1995, 74(12): 1812-1822. DOI:10.1016/0016-2361(95)80013-8 |
| [14] |
YANG H P, YAN R, CHEN H P, et al. In-depth investigation of biomass pyrolysis based on three major components:hemicellulose, cellulose and lignin[J]. Energy & Fuels, 2006, 20(1): 388-393. |
| [15] |
李晓博, 李晓, 李玉. 双孢蘑菇生产中木质素、纤维素和半纤维素的降解及利用研究[J]. 食用菌, 2009, 31(2): 6-8. LI X B, LI X, LI Y. Degradation and utilization of lignin, cellulose and hemicellulose in the production of agaricus bisporus[J]. Edible Fungi, 2009, 31(2): 6-8. (in Chinese) |
| [16] |
HU W, HU J H, WANG H, et al. Experimental research on molding biomass's carbonization homogeneity[J]. Advanced Materials Research, 2013, 634-638(1): 759-763. |
| [17] |
HASLER P, NUSSBAUMER T. Sampling and analysis of particles and tars from biomass gasifiers[J]. Biomass and Bioenergy, 2000, 18(1): 61-66. DOI:10.1016/S0961-9534(99)00071-9 |
| [18] |
EVANS R J, MILNE T A. Molecular characterization of the pyrolysis of biomass. 2. Applications[J]. Energy & Fuels, 1987, 1(4): 311-319. |
| [19] |
TYLER R J. Flash pyrolysis of coals. Devolatilization of a Victorian brown coal in a small fluidized-bed reactor[J]. Fuel, 1979, 58(9): 680-686. DOI:10.1016/0016-2361(79)90223-0 |
| [20] |
高正伟, 武震, 陈王琦, 等. 生物质气化中焦油特性及其处理[J]. 广州化工, 2015, 43(23): 50-52, 84. GAO Z W, WU Z, CHEN W Q, et al. The features and elimination of tar in biomass gasification processes[J]. Guangzhou Chemical Industry, 2015, 43(23): 50-52, 84. (in Chinese) DOI:10.3969/j.issn.1001-9677.2015.23.014 |
| [21] |
马欣欣.预处理和焦油催化重整对生物质热解制气性能的影响研究[D].北京: 北京化工大学, 2016. MA X X. Effect of impregnation and catalytic tar conversion on biomass pyrolysis for gas production[D]. Beijing: Beijing University of Chemical Technology, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10010-1016322527.htm |
| [22] |
吴正舜, 米铁, 陈义峰, 等. 生物质气化过程中焦油形成机理的研究[J]. 太阳能学报, 2010, 31(2): 233-236. WU Z S, MI T, CHEN Y F, et al. Study on the mechanism of tar formation during biomass gasification[J]. Acta Energiae Solaris Sinica, 2010, 31(2): 233-236. (in Chinese) |
| [23] |
CHO S H, LEE J, KIM K H, et al. Carbon dioxide assisted co-pyrolysis of coal and ligno-cellulosic biomass[J]. Energy Conversion and Management, 2016, 118: 243-252. |
| [24] |
OOCHIT D, SELVARAJOO A, ARUMUGASAMY S K. Pyrolysis of biomass[M]//SINGH L, KALIA V C. Waste biomass management-A holistic approach. New York: Springer International Publishing, 2017.
|
| [25] |
MANEERUNG T, LIEW J, DAI Y J, et al. Activated carbon derived from carbon residue from biomass gasification and its application for dye adsorption:kinetics, isotherms and thermodynamic studies[J]. Bioresource Technology, 2016, 200: 350-359. DOI:10.1016/j.biortech.2015.10.047 |
| [26] |
KÖSEOǦ LU E, AKMIL-BAŞAR C. Preparation, structural evaluation and adsorptive properties of activated carbon from agricultural waste biomass[J]. Advanced Powder Technology, 2015, 26(3): 811-818. |
| [27] |
MAHAMAD M N, ZAINI M A A, ZAKARIA Z A. Preparation and characterization of activated carbon from pineapple waste biomass for dye removal[J]. International Biodeterioration & Biodegradation, 2015, 102(4): 274-280. |
| [28] |
GOLDFARB J L, DOU G L, SALARI M, et al. Biomass-based fuels and activated carbon electrode materials:an integrated approach to green energy systems[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(4): 3046-3054. |
| [29] |
ZUBRIK A, MATIK M, HREDZÁK S, et al. Preparation of chemically activated carbon from waste biomass by single-stage and two-stage pyrolysis[J]. Journal of Cleaner Production, 2017, 143: 643-653. DOI:10.1016/j.jclepro.2016.12.061 |
| [30] |
XU S Z, LV Y L, ZENG X F, et al. ZIF-derived nitrogen-doped porous carbons as highly efficient adsorbents for removal of organic compounds from wastewater[J]. Chemical Engineering Journal, 2017, 323: 502-511. |
| [31] |
CHEUNG W H, SZETO Y S, MCKAY G. Intraparticle diffusion processes during acid dye adsorption onto chitosan[J]. Bioresource Technology, 2007, 98(15): 2897-2904. |








