癌症是一类重大且难治愈的疾病,从统计数据[1-3]来看,2008年全球范围内的新增癌症病例数约为1270万,死亡病例数约为760万;2011年全球范围内的新增癌症病例数约为1410万,死亡病例数约为820万;2018年全球范围内的新增癌症病例数约为1810万,死亡病例数约为960万。目前,癌症的治疗手段主要为手术、化疗和放疗,而这些治疗手段都存在着诸如创伤大、没有选择性地杀死肿瘤细胞及较大的毒副作用等[4]各种问题。因此,光热疗法作为一种切实有效的低风险肿瘤治疗技术,具有良好的发展前景。
光热疗法是通过特定波长的近红外光照射具有光热转换特性的材料,将光能转化为热能,使该区域温度升高到42℃以上以杀死肿瘤细胞的一种实验性疗法[5]。光热疗法目前仍处于研发阶段,距离实际应用还有一定距离,但其副作用较小、效率高。目前用于光热疗法的主要研究材料可分为4类,即贵金属纳米颗粒(Au、Ag)[6-8]、碳纳米材料(石墨烯、碳纳米管)[9-12]、金属和非金属化合物(CuS、MoS2)[13-15]和有机染料(ICG、Ce6)[16-20]。其中,氧化石墨烯(GO)[9, 12, 21]和MoS2单体[22-24]在光热治疗的研究中均获得了令人振奋的成果。Yang等[5]采用氨基聚乙二醇修饰纳米氧化石墨烯片(NGS),并将近红外荧光染料Cy7负载到其表面得到NGS-PEG-Cy7,随后将2mg/mL该复合物注射到小鼠体表的4T1肿瘤细胞内,在808nm近红外光(2.0W/cm2)的照射下,肿瘤组织局部温度可达50℃左右。Wang等[24]通过在MoS2纳米片表面枝接聚乙二醇400(PEG400)制备得到一种具有光热特性的复合物MoS2-PEG,0.25mg/mL的MoS2-PEG受808nm近红外光(1.0W/cm2)照射5min后肿瘤细胞存活率下降到30%左右。
本文提出将MoS2和GO两种光热转换材料进行复合以期两者在光热治疗中表现出协同作用。采用水热法制备GO-MoS2,并通过PEG表面修饰得到GO-MoS2-PEG纳米复合材料载体。考察了该纳米复合材料载体对盐酸阿霉素(DOX)的负载和释放能力,在808nm近红外光(2.0W/cm2)下的光热性能,以及对肿瘤细胞的光热治疗效果和肿瘤细胞对药物的摄取作用。
1 实验部分 1.1 试剂与仪器GO溶胶(质量分数1%),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,≥97%),阿拉丁试剂(上海)有限公司;九水合硫化钠(Na2S·9H2O,≥98%),天津市光复精细化工研究所;盐酸(质量分数37%),NaOH(分析纯),磷酸氢二钠(分析纯),磷酸二氢钠(分析纯),北京化工厂;四水合钼酸铵((NH4)6Mo7O24·4H2O,≥99%),L-半胱氨酸(≥98.5%),国药集团化学试剂有限公司;6arm-PEG15k-NH2(Mw=15000),北京键凯科技股份有限公司;盐酸阿霉素(DOX,≥99%),北京华奉联博科技有限公司;细胞活性检测试剂盒(CCK-8),4′, 6-二脒基-2-苯基吲哚(DAPI,≥98%),西格玛奥德里奇(上海)贸易有限公司;双抗,胎牛血清,DMEM培养基,Trypsin(胰消化酶),Hela细胞,北京协和细胞资源中心。
H-800型透射电子显微镜,日本Hitachi;Vertex 70傅立叶红外光谱仪,德国Bruker;UV-2600紫外可见分光光度计,日本Shimadzu;FC多功能酶标仪,美国Thermo Fisher Scientific;Ti-U荧光共聚焦显微镜,日本Nikon。
1.2 制备方法 1.2.1 GO-MoS2复合物称取0.2648g四水合钼酸铵和1.152g九水合硫化钠,分别溶解在25mL水中并超声30min;取2.5mL GO溶胶,加入去离子水100mL,超声30min使其分散均匀。将钼酸铵溶液缓慢加入至GO分散液中,搅拌30min(200r/min)后转移到三口烧瓶中,缓慢加入硫化钠溶液。然后将体系置于40℃水浴中,逐滴加入10mL 5mol/L的盐酸,搅拌反应1h。反应结束后加入2g L-半胱氨酸,调节pH到4.5后将反应液倒入水热釜中,放入烘箱进行反应(200℃,24h)。待反应结束冷却后,离心洗涤数次(每次5min,分别用乙醇和去离子水洗),收集样品。
取标定好浓度的GO-MoS2分散系25mL,超声10min后加入1.8g NaOH,55℃下水浴反应4h。反应结束后用HCl调节体系pH至1左右。将产物离心洗涤数次,直至上清液的pH接近中性,收集样品,干燥后保存备用。
1.2.2 GO-MoS2-PEG复合物取5mg 1.2.1节制备的GO-MoS2,使其充分分散于5mL去离子水中,加入25mg的6arm-PEG15k-NH2,超声15min后加入5mg EDC,超声30min,再次加入5mg EDC,超声20min后搅拌过夜(约200r/min)。然后将反应液转移到100kDa超滤管中,于3500r/min下离心数次,加少量去离子水收集,得到PEG修饰的GO-MoS2复合物(GO-MoS2-PEG),并储存于4℃下。
1.3 药物的负载和释放移取2mL 0.2mg/mL的GO-MoS2-PEG到5个20mL螺口瓶中,分别加入0.1、0.2、0.5、0.8和1.0mg/mL的DOX溶液,共进行3组实验(pH分别为5.5、7.0和8.0),避光搅拌过夜。反应结束后,采用pH 8.0的磷酸盐缓冲液(PBS)对样品进行离心洗涤数次,收集超滤液以计算DOX负载率并加少量水收集产品,得到载有DOX的GO-MoS2-PEG(DOX-GO-MoS2-PEG)。
将30mL pH分别为7.4和5.0的缓冲液置于两个烧杯中,加入等量的载药复合物。避光搅拌(200r/min),定时取样采用紫外可见分光光度计测定490nm下的吸光度值,然后根据标准曲线计算DOX的释放率。
1.4 细胞毒性测试采用CCK-8测定样品的毒性,选用的癌细胞为Hela细胞。分别配制不同浓度的GO-MoS2-PEG溶液。将1mL双抗和20mL胎牛血清加入到180mL高糖(DMEM)培养基中。将1mL融化的Hela冻存液加入到细胞培养盒中并加入20mL配好的培养基,混匀后将培养盒放入37℃培养箱(5% CO2)中培养6h,更换培养基(在光学显微镜下观测细胞生长到铺满视野范围的70%左右时可以进行后续的实验)。吸出培养基,加入2mL胰消化酶,使其与细胞充分接触,放回培养箱中消化10min,待细胞全部脱落。加入20mL培养基,将消化后的细胞等分为2份:一份用于细胞毒性实验;一份进行传代培养。将细胞液加入到96孔板中,每孔100μL(细胞数约为10000/孔)。然后将96孔板放到37℃下恒温培养24h。将20μL不同浓度的GO-MoS2-PEG溶液和载药复合物加入孔中(3孔为一组)并标号(其中3个孔分别加入20μL PBS作为对照),继续恒温培养6h。对相应的孔施加808nm激光(5min,2W/cm2)辐照,照射完毕后继续培养24h。每孔加入10μL CCK-8溶液,继续培养1h。使用酶标仪测定570nm处各孔的吸光度值,根据式(1)计算细胞存活率S。
| $ S=A_{c} / A_{0} \times 100 \% $ | (1) |
式中,Ae为实验组吸光度值,A0为空白组吸光度值。
1.5 细胞摄取将细胞液加入至8孔板中(细胞数约为7500/孔),每孔200μL,之后将8孔板放入恒温培养箱中培养12h。将40μL不同浓度的DOX和载药复合物(DOX-GO-MoS2-PEG)加入孔中,继续恒温培养24h。而后进行细胞染色,先吸出孔板中的液体,用PBS清洗细胞3次(每孔200μL,加入PBS后停留1min吸出);然后使用多聚甲醛固定细胞(每孔200μL,室温下固定10min);吸出孔板中的溶液,并再次用PBS清洗3次(每孔200μL,加入PBS后停留5min吸出);使用DAPI进行染色(每孔100μL),在37℃下培养8min。移去孔板中的溶液并用PBS冲洗3次(每孔200μL,每次停留5min),最后再次加入PBS(每孔100μL)。将孔板置于荧光共聚焦显微镜下进行观测。
2 结果与讨论 2.1 GO-MoS2-PEG的表征结果图 1(a)和(b)分别为GO-MoS2经6arm-PEG15k-NH2修饰前后的TEM图。石墨烯类材料是典型的二维片层结构,从图 1(a)中可以看到片层结构的存在,尺寸为1~2μm,在片层结构上存在柳叶状的MoS2纳米片,尺寸为30~50nm。从图 1(b)中可以看到,片层结构的尺寸明显减小,为500nm左右,这是由于PEG修饰过程中的超声操作所致[21]。

|
图 1 PEG修饰前后样品的TEM图片 Fig.1 TEM images before and after PEGylation |
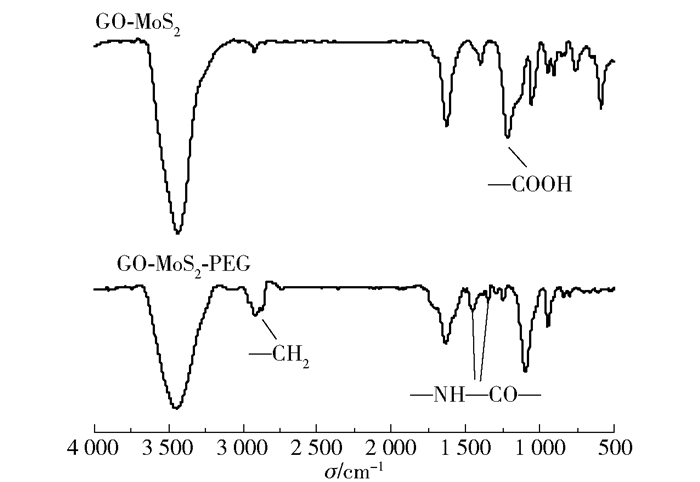
图 2为GO-MoS2经6arm-PEG15k-NH2修饰前后的红外谱图。样品经过多次离心洗涤,游离的PEG已被除去。2840~2960cm-1处出现的CH2伸缩振动峰说明PEG已成功枝接到GO-MoS2上。GO-MoS2在1223cm-1处存在羧酸的O—H产生的吸收峰,而由于6arm-PEG15k-NH2中的—NH2与GO中的—COOH反应生成了酰胺键(—NH—CO—),在GO-MoS2-PEG中可以看到1223cm-1处的吸收峰减弱,1456cm-1和1350cm-1处出现了酰胺键的峰,也说明了PEG成功枝接到GO-MoS2上[12]。
|
图 2 6arm-PEG15k-NH2修饰前后样品的红外光谱图 Fig.2 FT-IR spectra of GO-MoS2 before and after coating with 6arm-PEG15k-NH2 |
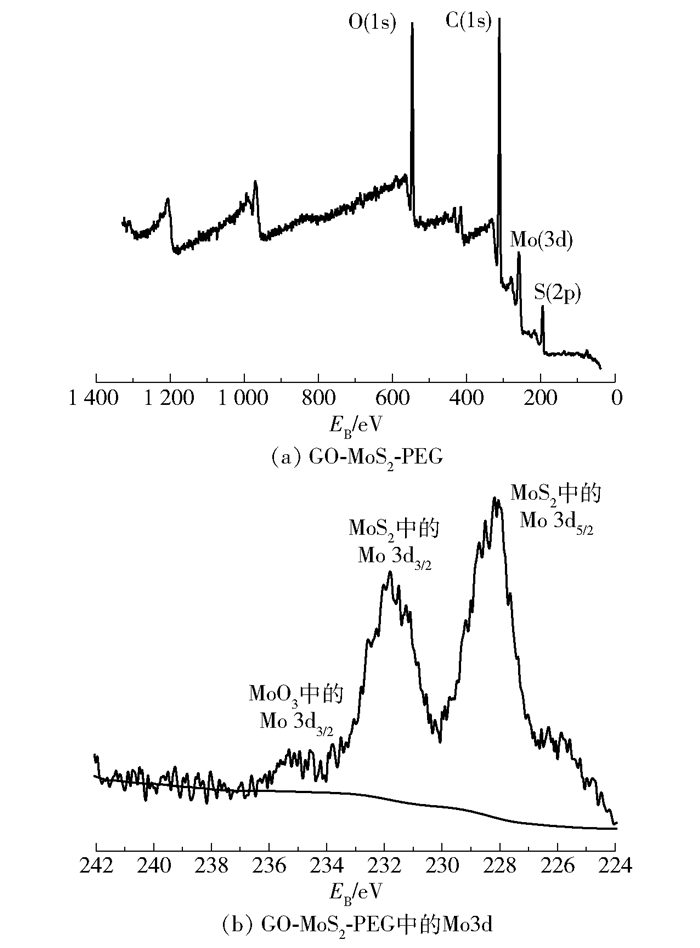
通过XPS(图 3)分析了样品的表面元素组成,发现样品中存在O、C、Mo、S 4种主要元素。MoS2中Mo的3d5/2和3d3/2峰分别位于结合能228.05eV和232.05eV处,S2s的峰位于结合能226.55eV处。而MoO3中Mo的3d3/2的峰位于结合能235.30eV处。可以看出,Mo4+的结合能峰远远强于Mo6+的结合能峰,说明样品中的Mo主要以MoS2的形式存在,极少量以MoO3的形式存在[25]。
|
图 3 GO-MoS2-PEG和GO-MoS2-PEG中的Mo3d的XPS谱图 Fig.3 XPS spectrum of GO-MoS2-PEG and Mo3d XPS spectrum in GO-MoS2-PEG |
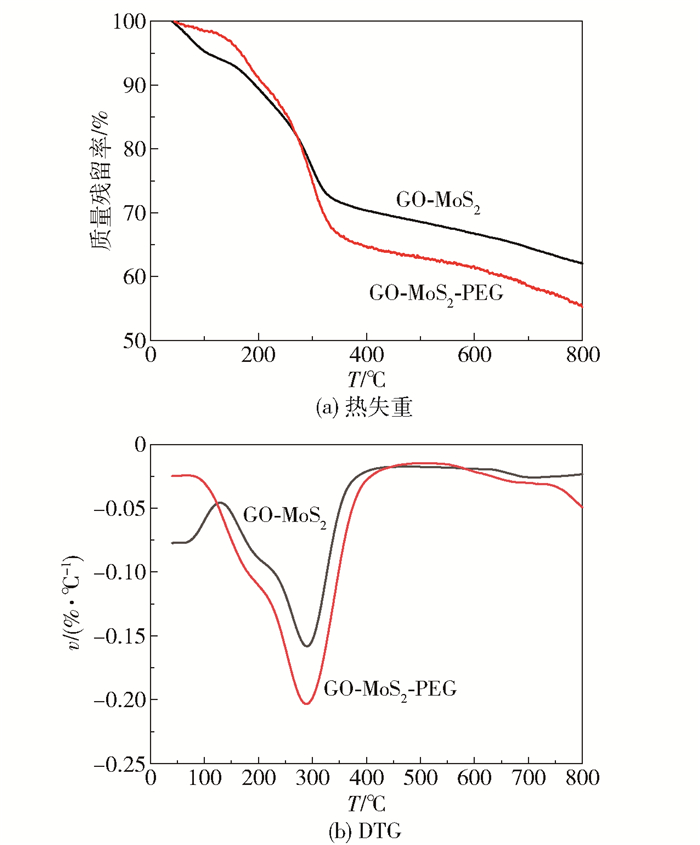
为了明确所制备的纳米复合材料载体中PEG的接枝量,采用热失重方法对样品进行分析。图 4中,低于100℃时损失的质量为样品所吸收的水分,200℃左右为样品主要的质量损失(GO含氧官能团分解),而250~400℃为PEG的热失重[26-27]。从图 4(b)可以看出,由于PEG在温度上升的过程中会分解,在低于400℃时,GO-MoS2-PEG比GO-MoS2的失重速率稍快,400℃之后GO- MoS2和GO- MoS2-PEG的失重趋势基本一致(MoS2在450℃时开始升华)。根据800℃时的质量损失比例的差值可以估算出样品上接枝的PEG的质量分数约为6.8%。
|
图 4 样品的TGA热失重曲线和DTG曲线 Fig.4 TGA and DTG curves of GO-MoS2 and GO-MoS2-PEG |
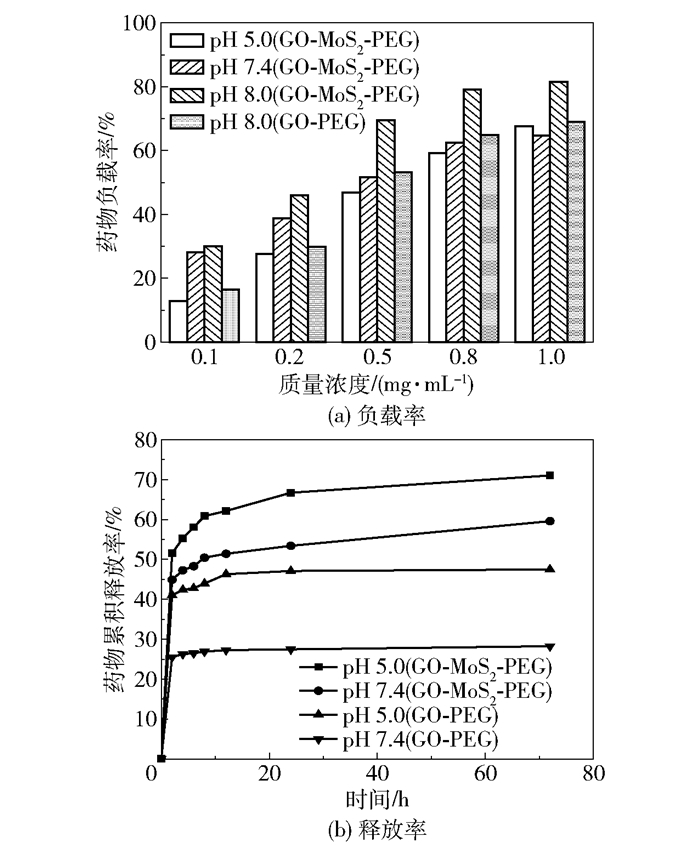
图 5(a)为不同pH条件下纳米复合材料的药物负载率曲线,可以看出:碱性条件(pH 8.0)更易于DOX负载(负载率为81.55%);而在同等条件下,DOX在GO-PEG上的负载率仅为69.08%,低于GO-MoS2-PEG组。这可能是由于在pH 8.0时,游离DOX表面带负电[22],本文制备的纳米复合材料GO-MoS2-PEG表面带正电(经Zeta电位仪测得其表面电位为23.6mV,而GO表面电位为-47.7mV),使得DOX可能由于静电力作用更容易负载到GO-MoS2-PEG上。
|
图 5 不同pH下GO-MoS2-PEG及GO-PEG的药物负载率和释放率曲线 Fig.5 Drug loadings and release efficiencies of drug carriers at various pH values |
图 5(b)则为不同pH条件下两种载药复合物(GO-MoS2-PEG和GO-PEG)的药物释放率曲线。在pH 5.0条件下,DOX的累积释放量明显高于pH 7.4条件下的释放量。这是由于DOX在酸性条件下(pH 5.0)表面带正电,更容易从载体上释放。GO-MoS2-PEG在pH 5.5和7.4条件下24h时的药物释放率分别为66.7%和53.4%,而GO-PEG在pH 5.0和7.4条件下24h时的释放率仅为47.1%和27.4%,说明GO-MoS2-PEG能够更有效地释放药物。
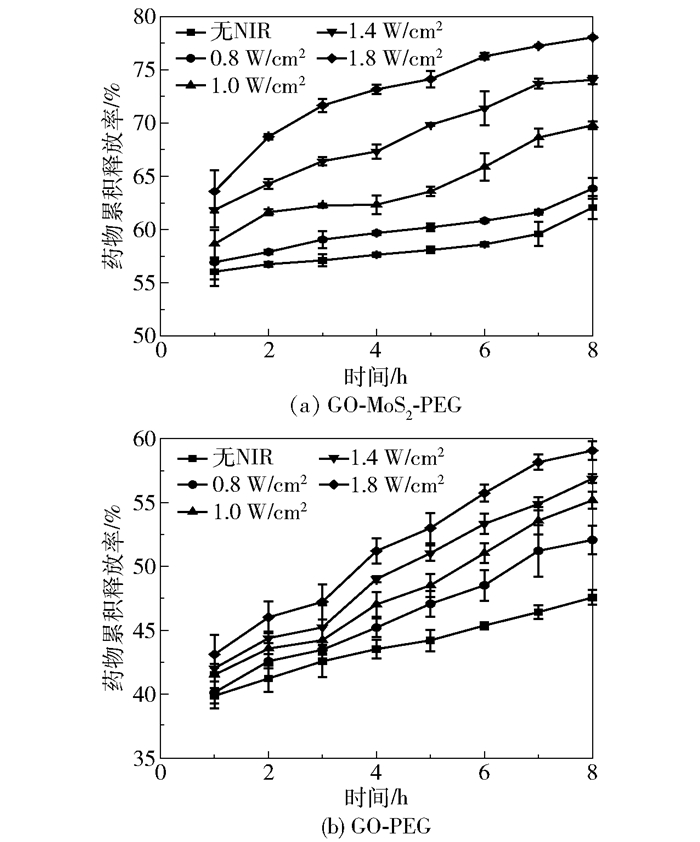
图 6为pH 5.0时,不同近红外(NIR)激光功率下GO-MoS2-PEG和GO-PEG的药物释放率曲线。可以看出,药物释放率随着激光功率的增大而增大,在1.8W/cm2时达到最大,此时GO-MoS2-PEG和GO-PEG的药物释放率分别达78.03%和59.07%,均大于无激光时的62.06%和47.47%。因此,可以说明所采用的NIR激光有促进DOX从药物载体上释放的作用,这可能是由于对体系施加的近红外光的一部分光能被两种材料转化为了热能,使得负载的DOX较为不稳定而从载体上释放出来。
|
图 6 不同功率下GO-MoS2-PEG和GO-PEG的药物释放率曲线 Fig.6 Drug release efficiencies of drug carriers GO-MoS2-PEG and GO-PEG under various NIR powers |
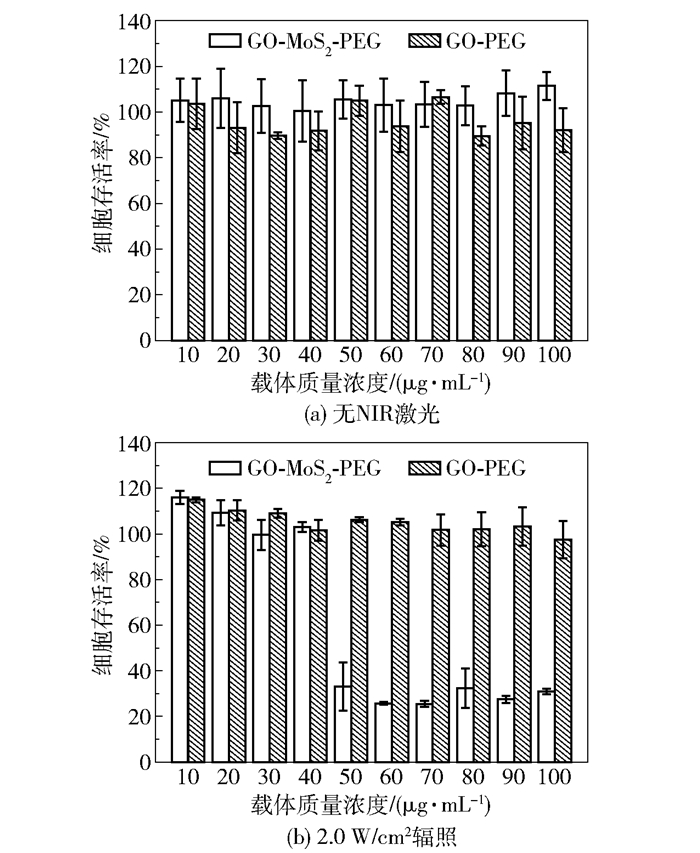
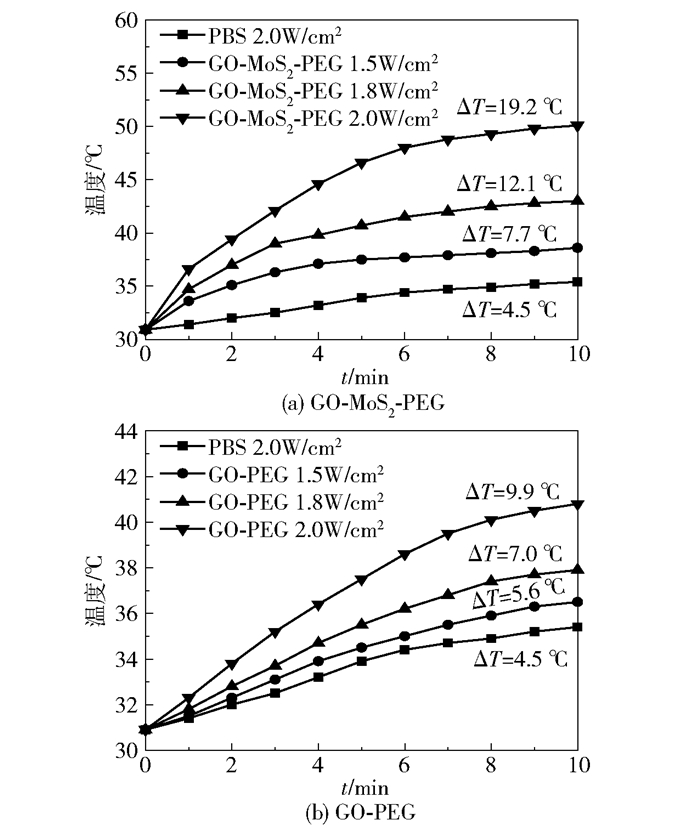
采用未载药的复合材料GO-MoS2-PEG和GO-PEG进行细胞毒性实验。从图 7(a)来看,无激光条件下,GO-MoS2-PEG和GO-PEG对Hela细胞均没有明显的细胞毒性,相对细胞存活率均高于90%,说明所制备的复合材料具有良好的生物相容性。在NIR功率为2.0W/cm2时(图 7(b)),GO-PEG实验组仍没有明显的细胞毒性,而浓度高于50μg/mL的GO-MoS2-PEG实验组则有明显细胞毒性,相对细胞存活率约为30%。出现这种相对细胞存活率骤降现象的原因是体系温度的升高。从50μg/mL的GO-MoS2-PEG溶液的升温曲线(图 8(a))可以看出,经功率为2.0W/cm2的NIR照射10min后,体系温度由30.9℃升高到了50.5℃(ΔT=19.2℃)。由于癌细胞对高温的耐受能力较差,会因为高温使结构遭到破坏,进而解体死亡,达到光热治疗的目的。而图 8(b)中,相同条件下的GO-PEG实验组体系温度仅从30.9℃升高到40.8℃(ΔT=9.9℃),不及光热治疗的阀值温度(42℃),无法达到有效的光热治疗的目的。
|
图 7 无NIR激光和2.0W/cm2辐照下不同浓度载体的细胞毒性 Fig.7 The toxicity of drug carriers at various concentrations under no NIR and 2.0W/cm2 of NIR |
|
图 8 不同功率下GO-MoS2-PEG和GO-PEG的升温曲线 Fig.8 The temperature rise curves of GO-MoS2-PEG and GO-PEG under various NIR powers |
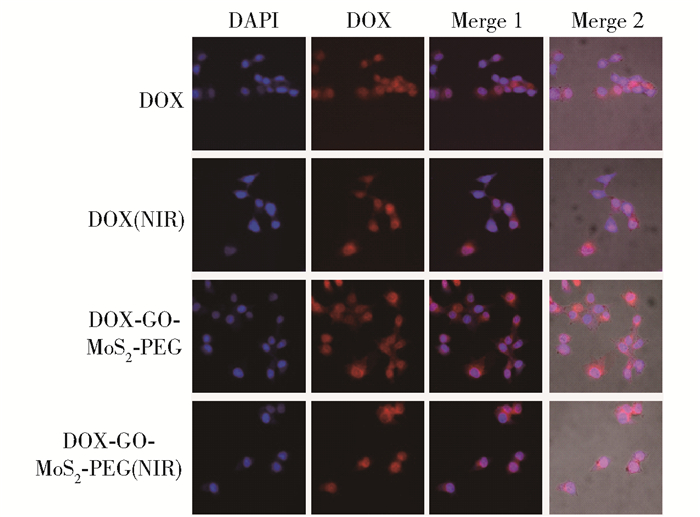
图 9为DOX和DOX-GO-MoS2-PEG在无NIR激光和NIR激光功率为2.0W/cm2条件下的荧光共聚焦照片。Merge 1为DAPI和DOX的荧光照片叠加图,Merge 2为在Merge1基础上叠加明场照片后的照片。在游离DOX的实验组中,Merge 1一栏中仅有少量红蓝重叠的现象,说明DOX仅进入了少部分细胞的细胞核中,而Merge 2中大部分为蓝色圆点外围绕着一圈红色,说明药物仅进入到Hela细胞的细胞质中,无法发挥应有的药效;在无NIR激光参与的DOX-GO-MoS2-PEG实验组中,可以观测到Merge 1中的红蓝荧光的重叠现象,说明DOX成功进入了细胞核,但同时也有药物仅进入细胞质的情况,从叠加了明场照片的Merge 2中可以更为清晰地观测到这种现象,其与游离DOX实验组情况类似,而在细胞质中的DOX无法抑制DNA的转录从而杀死Hela细胞。在有NIR激光参与的游离DOX实验组中,上述现象仍然存在,药物仅存在于Hela细胞的细胞质,说明NIR激光并无促进DOX进入Hela细胞细胞核的作用;而在有NIR激光参与的DOX-GO-MoS2-PEG实验组中,情况则相反,视野中全部细胞均有红蓝荧光的重叠,即所有Hela细胞的细胞核中均有DOX进入并发挥作用。与有NIR激光参与的游离DOX实验组对比,说明NIR能够促进DOX-GO-MoS2-PEG上负载的DOX进入Hela细胞的细胞核并发挥作用。
|
图 9 DOX和DOX-GO-MoS2-PEG在无NIR激光以及激光功率为2.0W/cm2时的染核实验照片 Fig.9 DAPI pictures of DOX and DOX-GO-MoS2-PEG without NIR and under NIR power of 2.0W/cm2 |
本文制备了一种PEG接枝量为6.8%的GO-MoS2-PEG复合物,其生物相容性良好,具有明显的光热转换的特性;质量浓度为50μg/mL的纳米复合材料在功率为2.0W/cm2的808nm激光下照射10min,其温度可升至50.5℃,相对细胞存活率仅为30%左右,可对癌细胞起到有效的杀灭作用。
| [1] |
JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA:A Cancer Journal for Clinicians, 2011, 61(2): 69-90. DOI:10.3322/caac.v61:2 |
| [2] |
TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA:A Cancer Journal for Clinicians, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [3] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA:A Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.v68.6 |
| [4] |
孔祥权, 严刚, 邝淼, 等. 还原氧化石墨烯-硫化铜纳米复合材料的制备及在癌症热疗中的应用[J]. 高等学校化学学报, 2016, 37(1): 1-6. KONG X Q, YAN G, KUANG M, et al. Preparation of reduced graphene oxide-copper sulfide composite as efficient photothermal agents for ablation of cancer[J]. Chemical Journal of Chinese Universities, 2016, 37(1): 1-6. (in Chinese) |
| [5] |
YANG K, ZHANG S, ZHANG G X, et al. Graphene in mice:ultrahigh in vivo tumor uptake and efficient photothermal therapy[J]. Nano Letters, 2010, 10(9): 3318-3323. DOI:10.1021/nl100996u |
| [6] |
MUKHERJEE S, CHOWDHURY D, KOTCHERLAKOTA R, et al. Potential theranostics application of bio-synthesized silver nanoparticles (4-in-1 system)[J]. Theranostics, 2014, 4(3): 316-335. DOI:10.7150/thno.7819 |
| [7] |
FALES A M, YUAN H, VO-DINH T. Silica-coated gold nanostars for combined surface-enhanced Raman scattering (SERS) detection and singlet-oxygen generation:a potential nanoplatform for theranostics[J]. Langmuir, 2011, 27(19): 12186-12190. DOI:10.1021/la202602q |
| [8] |
HUANG P, BAO L, ZHANG C L, et al. Folic acid-conjugated silica-modified gold nanorods for X-ray/CT imaging-guided dual-mode radiation and photo-thermal therapy[J]. Biomaterials, 2011, 32(36): 9796-9809. DOI:10.1016/j.biomaterials.2011.08.086 |
| [9] |
AKHAVAN O, GHADERI E. Graphene nanomesh promises extremely efficient in vivo photothermal therapy[J]. Small, 2013, 9(21): 3593-3601. DOI:10.1002/smll.201203106 |
| [10] |
DAS M, DATIR S R, SINGH R P, et al. Augmented anticancer activity of a targeted, intracellularly activatable, theranostic nanomedicine based on fluorescent and radiolabeled, methotrexate-folic acid-multiwalled carbon nanotube conjugate[J]. Molecular Pharmaceutics, 2013, 10(7): 2543-2557. DOI:10.1021/mp300701e |
| [11] |
MARKOVIC Z M, HARHAJI-TRAJKOVIC L M, TODOROVIC-MARKOVIC B M, et al. In vitro comparison of the photothermal anticancer activity of graphene nanoparticles and carbon nanotubes[J]. Biomaterials, 2011, 32(4): 1121-1129. |
| [12] |
SUN X M, LIU Z, WELSHER K, et al. Nano-graphene oxide for cellular imaging and drug delivery[J]. Nano Research, 2008, 1(3): 203-212. DOI:10.1007/s12274-008-8021-8 |
| [13] |
HAN J Y, XIA H P, WU Y F, et al. Single-layer MoS2 nanosheet grafted upconversion nanoparticles for near-infrared fluorescence imaging-guided deep tissue cancer phototherapy[J]. Nanoscale, 2016, 8(15): 7861-7865. DOI:10.1039/C6NR00150E |
| [14] |
LI Y B, BAI X L, XU M M, et al. Photothermo-responsive Cu7S4@polymer nanocarriers with small sizes and high efficiency for controlled chemo/photothermo therapy[J]. Science China Materials, 2016, 59(4): 254-264. DOI:10.1007/s40843-016-5035-6 |
| [15] |
LIU T, SHI S X, LIANG C, et al. Iron oxide decorated MoS2 nanosheets with double PEGylation for chelator-free radiolabeling and multimodal imaging guided photothermal therapy[J]. ACS Nano, 2015, 9(1): 950-960. DOI:10.1021/nn506757x |
| [16] |
CHEN J Q, LIU C B, ZENG G, et al. Indocyanine green loaded reduced graphene oxide for in vivo photoacoustic/fluorescence dual-modality tumor imaging[J]. Nanoscale Research Letters, 2016, 11(1): 85. DOI:10.1186/s11671-016-1288-x |
| [17] |
CHEN Q, WANG X, WANG C, et al. Drug-induced self-assembly of modified albumins as nano-theranostics for tumor-targeted combination therapy[J]. ACS Nano, 2015, 9(5): 5223-5233. DOI:10.1021/acsnano.5b00640 |
| [18] |
MD SHARKER S M, LEE J E, KIM S H, et al. pH triggered in vivo photothermal therapy and fluorescence nanoplatform of cancer based on responsive polymer-indocyanine green integrated reduced graphene oxide[J]. Biomaterials, 2015, 61: 229-238. DOI:10.1016/j.biomaterials.2015.05.040 |
| [19] |
ZHANG C, LU T, TAO J G, et al. Co-delivery of paclitaxel and indocyanine green by PEGylated graphene oxide:a potential integrated nanoplatform for tumor theranostics[J]. RSC Advances, 2016, 6(19): 15460-15468. DOI:10.1039/C5RA25518J |
| [20] |
ZHENG M B, ZHAO P F, LUO Z Y, et al. Robust ICG theranostic nanoparticles for folate targeted cancer imaging and highly effective photothermal therapy[J]. ACS Applied Materials & Interfaces, 2014, 6(9): 6709-6716. |
| [21] |
YANG K, FENG L Z, HONG H, et al. Preparation and functionalization of graphene nanocomposites for biomedical applications[J]. Nature Protocols, 2013, 8(12): 2392-2403. DOI:10.1038/nprot.2013.146 |
| [22] |
YIN W Y, YAN L, YU J, et al. High-throughput synthesis of single-layer MoS2 nanosheets as a near-infrared photothermal-triggered drug delivery for effective cancer therapy[J]. ACS Nano, 2014, 8(7): 6922-6933. DOI:10.1021/nn501647j |
| [23] |
HUANG B, WANG D L, WANG G, et al. Enhancing the colloidal stability and surface functionality of molybdenum disulfide (MoS2) nanosheets with hyperbranched polyglycerol for photothermal therapy[J]. Journal of Colloid & Interface Science, 2017, 508: 214-221. |
| [24] |
WANG S G, LI K, CHEN Y, et al. Biocompatible PEGylated MoS2 nanosheets:controllable bottom-up synthesis and highly efficient photothermal regression of tumor[J]. Biomaterials, 2015, 39: 206-217. DOI:10.1016/j.biomaterials.2014.11.009 |
| [25] |
TANG Y P, WU D Q, MAI Y Y, et al. A two-dimensional hybrid with molybdenum disulfide nanocrystals strongly coupled on nitrogen-enriched graphene via mild temperature pyrolysis for high performance lithium storage[J]. Nanoscale, 2014, 6(24): 14679-14685. DOI:10.1039/C4NR05519E |
| [26] |
STANKOVICH S, DIKIN D A, PINER R D, et al. Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide[J]. Carbon, 2007, 45(7): 1558-1565. DOI:10.1016/j.carbon.2007.02.034 |
| [27] |
徐国强, 徐鹏武, 施冬健, 等. PEG接枝氧化石墨烯的制备与细胞成像[J]. 无机化学学报, 2014, 30(9): 1994-1999. XU G Q, XU P W, SHI D J, et al. Preparation and cellular imaging of PEG grafted graphene oxide[J]. Chinese Journal of Inorganic Chemistry, 2014, 30(9): 1994-1999. (in Chinese) |








