2. 化学工程学院 教育部超重力工程研究中心, 北京 100029
2. Research Center of the Ministry of Education for High Gravity Engineering and Technology, Beijing University of Chemical Technology, Beijing 100029, China
自2015年实施新的《中华人民共和国环境保护法》以来,具有高色度、高毒性、难降解特点的染料废水成为国家重点整治的对象[1-2]。随着纺织染整工艺的进步,新型废水处理技术不断涌现,其中高级氧化技术由于具有效率高、无选择性等优点,在染料废水处理领域展现出广阔的应用前景[3]。
传统的高级氧化技术以羟基自由基为氧化剂,但其半衰期仅为10-4s。与OH·(E0=+1.8~+2.7V)相比,硫酸根自由基SO4-·(E0=+2.5~+3.1V)不仅有较高的标准电极电势,而且半衰期可达4s,从而具有更强的氧化性。同时,OH·的应用受到H2O2分解或O3分解的影响,对环境有一定要求,而SO4-·对pH的适应范围更广。因此在废水处理领域,相对于传统高级氧化法所使用的羟基自由基,硫酸根自由基显现出独特的优势。
SO4-·可以通过过渡金属离子活化过硫酸钠(PS)产生。PS在常温下较稳定、半衰期长、易储存和运输、水溶性好、安全性高,在铁离子的活化下可以高效产生SO4-·,从而对有机污染物达到较强的氧化降解能力[4-8]。但关于其他金属离子对PS活化作用的研究尚不多见[9]。
本文以靛蓝胭脂红(IC)模拟染料废水的脱色率为考察指标,首次探讨并比较了Fe2+、Ag+、Cu2+、Mn2+、Mg2+、Zn2+等6种金属离子对PS的活化效果,发现Fe2+活化PS的效果最好,并进一步考察了PS浓度、Fe2+浓度、温度、pH等因素对Fe2+活化PS降解IC的影响规律。
1 实验部分 1.1 药品与试剂靛蓝胭脂红,纯度96%,CAS 860-22-0,上海阿拉丁生化科技股份有限公司;过硫酸钠、七水合硫酸亚铁、一水合硫酸锰、五水合硫酸铜、硫酸银、七水合硫酸锌、无水硫酸镁,均为分析纯,国药集团化学试剂有限公司;氢氧化钠和浓硫酸,均为分析纯,北京化工厂。
1.2 实验方法本文以搅拌釜式反应器(STR)为反应装置,以水浴恒温磁力搅拌器为混合装置。
先用电子天平称量400mg IC,将其溶于2000mL的去离子水中配置成质量浓度为200mg/L的模拟IC染料废水(初始pH为7.3,初始CODcr为200mg/L;取该废水样品200mL,调整至需要的酸碱度(采用1mol/L的氢氧化钠和1mol/L的浓硫酸来调节溶液的pH)和温度后放入STR中;然后在样品中按设定的浓度加入一定量的PS,如用金属离子活化,则加入一定浓度的金属离子;随后开启搅拌装置,对IC模拟染料废水进行脱色;加入药品的同时打开秒表计时,每隔一定时间用移液管量取一定体积的水样,其中金属离子活化PS的单因素实验取样时间分别为第1、3、5、7、9、11、13、15、17、19min。为降低PS与IC持续反应对实验结果造成的影响,需迅速取样至试管中,并用移液管加入适量的去离子水将样品稀释到指定倍数。随后通过DR 6000紫外可见光分光光度计(美国哈希公司)检测IC浓度。
IC浓度测定过程为:配制不同浓度的IC标准溶液,在其特征波长610nm下检测吸光度,根据朗伯-比尔定律,建立浓度-吸光度标准曲线,经过回归得出浓度-吸光度的线性方程如式(1)所示。
| $ A=0.00676+0.03662\rho , {{R}^{2}}=0.9998 $ | (1) |
式中,A为吸光度,ρ为IC标准溶液的质量浓度,mg/L。
在IC的特征波长下根据浓度-吸光度标准曲线将吸光度转化为浓度,根据式(2)计算模拟染料废水的脱色率
| $ {{\lambda }_{\text{IC}}}=\frac{({{\rho }_{\text{IC}, 0}}-{{\rho }_{\text{IC}, i}})}{{{\rho }_{\text{IC}, 0}}}\times 100\% $ | (2) |
其中,λIC为模拟染料废水的脱色率,%;ρIC, 0为模拟染料废水处理前的质量浓度,mg/L;ρIC, i为模拟染料废水处理后的质量浓度,mg/L。
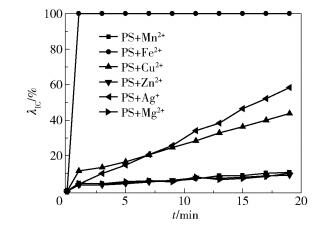
2 结果与讨论 2.1 6种金属离子对PS活化效果的比较温度为25℃,染料废水的质量浓度为200mg/L,体积为200mL,pH为7.3,PS的投加量为10mmol/L,金属离子的投加量为1mmol/L,金属离子包括Mn2+、Fe2+、Cu2+、Zn2+、Ag+、Mg2+等6种,在此条件下,考察不同金属离子活化PS降解IC模拟染料废水的效果,结果如图 1所示。
|
图 1 6种金属离子对PS的活化效果 Fig.1 Activation effect of six metallic ions on sodium persulfate |
由图 1可看出,不同金属离子活化PS的效果存在较大差别。通过比较可以发现这6种金属离子对PS的活化能力的排序为Fe2+>Ag+>Cu2+>Mn2+>Mg2+>Zn2+,对应在第19min时的染料脱色率分别为100%、58.41%、43.76%、10.58%、10.11%和8.98%。
通过6种金属离子的对比可看出过渡金属离子Fe2+、Ag+、Cu2+对PS具有良好的活化性能,能够为PS提供电子,激发PS产生SO4-·[10],而Mn2+、Mg2+、Zn2+对PS的活化作用较小。非过渡金属离子Mg2+也有活化效果,但效果较差。过渡金属离子与PS的反应如式(3)所示[11]
| $ {{\text{M}}^{n+}}\text{+}{{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}\to {{\text{M}}^{\left( n\text{+1} \right)\text{+}}}\text{+ SO}_{4}^{-}\text{ }\!\!\cdot\!\!\text{ +SO}_{4}^{2-}\text{ }\!\!~\!\!\text{ } $ | (3) |
过渡金属离子Fe2+活化PS在1min内就可使染料废水完全脱色,表明其活化效果明显优于其他金属离子。同时,Fe2+在自然界中大量存在,易处理且对水体的污染较小,因此后续实验选用Fe2+对PS进行活化,探究其最优脱色条件。
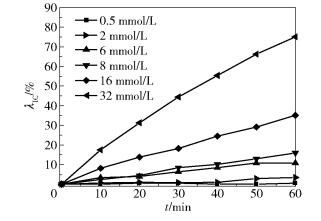
2.2 PS浓度的影响温度为25℃,染料废水质量浓度为200mg/L,体积为200mL,pH为7.3,PS的浓度分别为0.5mmol/L、2mmol/L、6mmol/L、8mmol/L、16mmol/L、32mmol/L,在此条件下考察未经金属离子活化的不同浓度PS对染料废水的处理效果,结果如图 2所示。
|
图 2 PS浓度对IC降解的影响 Fig.2 Effect of PS concentration on indigo carmine degradation |
如图 2所示,未经过活化的PS本身具有强氧化性,能攻击IC的发色基团,对IC染料废水有一定的降解效果。随着PS浓度的增加,染料废水的脱色率升高,在60min时,当PS浓度从0.5mmol/L增加到32mmol/L,废水的脱色率由0.53%上升至75.11%。
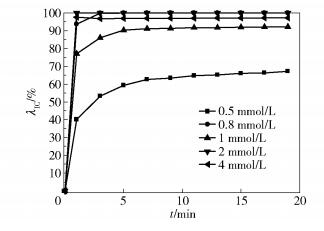
2.3 Fe2+浓度的影响 2.3.1 PS与Fe2+的投加物质的量比为1:1时温度为25℃,染料废水的质量浓度为200mg/L,体积为200mL,pH为7.3,PS与Fe2+的投加物质的量比为1:1,投加量分别为0.5mmol/L、0.8mmol/L、1mmol/L、2mmol/L、4mmol/L,考察上述条件下同一比例不同浓度的PS和Fe2+对染料废水的处理效果,结果如图 3所示。
|
图 3 Fe2+浓度对IC降解的影响(cPS/cFe2+=1) Fig.3 Effect of Fe2+ concentration on indigo carmine degradation (cPS/cFe2+=1) |
如图 3所示,随着PS与Fe2+投加量的增加,染料废水的脱色率和脱色效率均增加,在0.8mmol/L的投加量下,脱色率在5min内达到100%。这是因为Fe2+在室温下就能对PS进行活化,生成大量的SO4-·,反应如式(4)所示[12]
| $ \text{F}{{\text{e}}^{\text{2+}}}\text{+}{{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}\to \text{F}{{\text{e}}^{\text{3+}}}\text{+SO}_{4}^{-}\text{ }\!\!\cdot\!\!\text{ +SO}_{4}^{2-} $ | (4) |
SO4-·能使IC中的不饱和键断裂,SO42-能与IC的分解产物进行加成反应。随着PS与Fe2+投加量继续增加至4mmol/L,染料废水的脱色率却稍有下降。这是因为随着反应物PS与Fe2+浓度的增加,生成物SO4-·自身会发生湮灭反应,从而造成对染料的降解效果下降,反应如式(5)所示[13]
| $ \text{SO}_{4}^{-}\text{ }\!\!\cdot\!\!\text{ +SO}_{4}^{-}\text{ }\!\!\cdot\!\!\text{ }\to {{\text{S}}_{\text{2}}}\text{O}_{8}^{2-} $ | (5) |
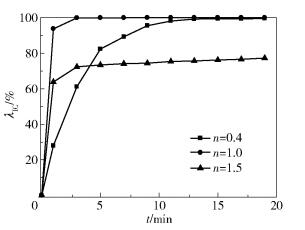
温度为25℃,染料废水的质量浓度为200mg/L,体积为200mL,pH为7.3,PS与Fe2+的投加物质的量比为1:n,n为0.4、1、1.5,固定PS的浓度为0.8mmol/L,考察不同PS、Fe2+的投加物质的量比对染料废水的处理效果,结果如图 4所示。
|
图 4 Fe2+浓度对IC降解的影响(cPS=0.8mmol/L) Fig.4 Effect of Fe2+ concentration on indigo carmine degradation (cPS=0.8mmol/L) |
如图 4所示,当PS与Fe2+的投加物质的量比为1:0.4时,在19min测得染料废水的脱色率为99.44%,而当PS与Fe2+的投加物质的量比为1:1时,脱色率在5min内达到100%。这是因为当活化剂Fe2+的浓度较低时,SO4-·的生成量偏小,随着活化剂Fe2+浓度的增加,活化效果增强,即对废水的脱色率增加。
当PS与Fe2+的投加物质的量比为1:1.5时,在19min测得染料废水的脱色率为77.25%,脱色率低于1:0.4和1:1的投加量。这主要是因为过量的Fe2+会与目标污染物竞争SO4-·,生成Fe3+,消耗体系中的SO4-·,反应如式(6)所示
| $ \text{SO}_{4}^{-}\text{ }\!\!\cdot\!\!\text{ +F}{{\text{e}}^{\text{2+}}}\to \text{SO}_{4}^{2-}\text{+F}{{\text{e}}^{\text{3+}}} $ | (6) |
除此之外,过量的Fe2+会增加水处理负担,降低经济效益。综上所述,在后续实验中PS与Fe2+的投加比例确定为1:1,投加量为0.8mmol/L。
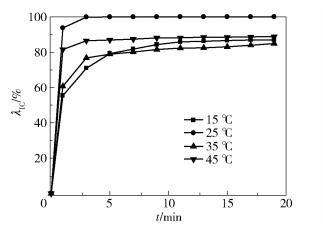
2.4 温度的影响染料废水的质量浓度为200mg/L,体积为200mL,pH为7.3,PS与Fe2+的投加量均为0.8mmol/L,温度分别为15℃、25℃、35℃、45℃,考察不同温度对染料废水的处理效果,结果如图 5所示。
|
图 5 温度对IC降解的影响 Fig.5 Effect of temperature on indigo carmine degradation |
如图 5所示,本文实验体系存在最佳反应温度,即25℃。一定范围内,温度的升高对脱色效果有贡献,因为热能激发PS生成SO4-·,反应方程如式(7)所示[14]
| $ {{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}\xrightarrow{\text{heat}}\text{2SO}_{4}^{-}\text{ }\!\!\cdot\!\!\text{ } $ | (7) |
但因升温而大量产生的SO4-·之间会发生湮灭反应,因此高温下的脱色效果不如常温,这与Hori等[15]的研究相符。
当温度降至15℃时染料的脱色效果也较差,出现这一现象可能是温度降低,IC的降解反应速率变慢所致。
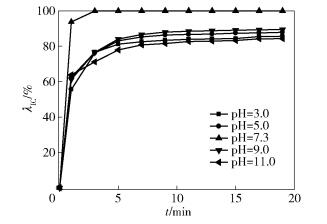
2.5 pH的影响温度为25℃,染料废水的质量浓度为200mg/L,体积为200mL,PS与Fe2+的投加量均为0.8mmol/L,调节pH分别为3.0、5.0、7.3、9.0、11.0,考察不同pH对靛蓝胭脂红模拟染料废水的处理效果,结果如图 6所示。
|
图 6 pH对IC降解的影响 Fig.6 Effect of pH on indigo carmine degradation |
如图 6所示,pH对IC的降解效果有较大影响。pH为7.3时的处理效果最佳,酸性条件和碱性条件对染料废水的脱色均有不利影响。
酸性条件下目标污染物的脱色率降低,是因为Fe2+在酸性条件下会以多种铁离子水合物的形式存在[16],导致活化剂浓度降低,进而降低活化效率;同时,H+也会活化S2O82-,产生SO4-·,大量的SO4-·之间会发生湮灭,降低了对目标污染物的降解效果[17]。在碱性条件下,OH-会与Fe2+生成Fe(OH)2,降低了Fe2+的利用率,使得生成的SO4-·减少,导致IC的脱色率降低。
3 结论(1) 在Mn2+、Fe2+、Cu2+、Zn2+、Ag+、Mg2+这6种金属离子中,Fe2+能显著提升过硫酸钠降解靛蓝胭脂红模拟染料废水的效果,非过渡金属离子Mg2+也具有活化过硫酸钠的作用。
(2) 使用Fe2+活化PS降解模拟染料废水的结果表明,当温度为25℃,靛蓝胭脂红模拟染料废水的质量浓度为200mg/L,pH为7.3,PS与Fe2+的投加量均为0.8mmol/L时,靛蓝胭脂红模拟染料废水的脱色率在5min内可达到100%。
(3) 推测降解靛蓝胭脂红时的反应机理为:由PS生成的SO4-·主动进攻靛蓝胭脂红中的C=C键使其断裂,同时与苯环发生电子转移作用;随后靛蓝胭脂红的分解产物与SO42-发生加成反应,使其进一步被氧化降解。
| [1] |
温沁雪, 王进, 郑明明, 等. 印染废水深度处理技术的研究进展及发展趋势[J]. 化工环保, 2015, 35(4): 363-369. WEN Q X, WANG J, ZHENG M M, et al. Research progresses and development trends of technologies for dyeing wastewater advanced treatment[J]. Environmental Protection of Chemical Industry, 2015, 35(4): 363-369. (in Chinese) DOI:10.3969/j.issn.1006-1878.2015.04.007 |
| [2] |
JOO D J, SHIN W S, CHOI J H, et al. Decolorization of reactive dyes using inorganic coagulants and synthetic polymer[J]. Dyes and Pigments, 2007, 73(1): 59-64. DOI:10.1016/j.dyepig.2005.10.011 |
| [3] |
LIANG C J, BRUELL C J, MARLEY M C, et al. Thermally activated persulfate oxidation of trichloroethylene (TCE) and 1, 1, 1-trichloroethane (TCA) in aqueous systems and soil slurries[J]. Soil and Sediment Contamination:An International Journal, 2003, 12(2): 207-228. DOI:10.1080/713610970 |
| [4] |
PENG H J, ZHANG W, LIU L, et al. Degradation performance and mechanism of decabromodiphenyl ether (BDE209) by ferrous-activated persulfate in spiked soil[J]. Chemical Engineering Journal, 2017, 307: 750-755. DOI:10.1016/j.cej.2016.08.129 |
| [5] |
VICENTE F, SANTOS A, ROMERO A, et al. Kinetic study of diuron oxidation and mineralization by persulphate:effects of temperature, oxidant concentration and iron dosage method[J]. Chemical Engineering Journal, 2011, 170(1): 127-135. DOI:10.1016/j.cej.2011.03.042 |
| [6] |
KHAN J A, HE X X, SHAH N S, et al. Kinetic and mechanism investigation on the photochemical degradation of atrazine with activated H2O2, S2O82- and HSO5-[J]. Chemical Engineering Journal, 2014, 252(18): 393-403. |
| [7] |
张丽娜, 钟华, 张俊涛, 等. 热, 碱和Fe3O4激活过硫酸钠降解二恶烷的对比研究[J]. 中国环境科学, 2017, 37(10): 3741-3747. ZHANG L N, ZHONG H, ZHANG J T, et al. A comparative study on activation of persulfate by heat, base and Fe3O4 for degradation of 1, 4-dioxane[J]. China Environmental Science, 2017, 37(10): 3741-3747. (in Chinese) DOI:10.3969/j.issn.1000-6923.2017.10.016 |
| [8] |
赵进英, 张耀斌, 全燮, 等. 加热和亚铁离子活化过硫酸钠氧化降解4-CP的研究[J]. 环境科学, 2010, 31(5): 1233-1238. ZHAO J Y, ZHANG Y B, QUAN X, et al. Sodium peroxydisulfate activation by heat and Fe(Ⅱ) for the degradation of 4-CP[J]. Environmental Science, 2010, 31(5): 1233-1238. (in Chinese) |
| [9] |
PELUFFO M, PARDO F, SANTOS A, et al. Use of different kinds of persulfate activation with iron for the remediation of a PAH-contaminated soil[J]. Science of the Total Environment, 2016, 563/564: 649-656. DOI:10.1016/j.scitotenv.2015.09.034 |
| [10] |
袁蓁, 隋铭皓, 袁博杰, 等. 基于硫酸根自由基的活化过硫酸盐新型高级氧化技术研究新进展[J]. 四川环境, 2016, 35(5): 142-146. YUAN Z, SUI M H, YUAN B J, et al. Research progress of novel sulfate radical-based advanced oxidation process using activated persulfate[J]. Sichuan Environment, 2016, 35(5): 142-146. (in Chinese) DOI:10.3969/j.issn.1001-3644.2016.05.028 |
| [11] |
刘桂芳, 孙亚全, 陆洪宇, 等. 活化过硫酸盐技术的研究进展[J]. 工业水处理, 2012, 32(12): 6-10. LIU G F, SUN Y Q, LU H Y, et al. Research progress in activated persulfate technology[J]. Industrial Water Treatment, 2012, 32(12): 6-10. (in Chinese) |
| [12] |
LIANG C J, BRUELL C J, MARLEY M C, et al. Persulfate oxidation for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate-thiosulfate redox couple[J]. Chemosphere, 2004, 55(9): 1213-1223. DOI:10.1016/j.chemosphere.2004.01.029 |
| [13] |
张成.基于硫酸根自由基的过硫酸钠高级氧化法氧化降解染料的研究[D].广州: 华南理工大学, 2012. ZHANG C. Research of the oxidation degradation of the dyes by the sulfate free radicals generated by sodium persulfate[D]. Guangzhou: South China University of Technology, 2012. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10561-1012449713.htm |
| [14] |
WALDEMER R H, TRATNYEK P G, JOHNSON R L, et al. Oxidation of chlorinated ethenes by heat-activated persulfate:kinetics and products[J]. Environmental Science & Technology, 2007, 41(3): 1010-1015. |
| [15] |
HORI H, NAGAOKA Y, MURAYAMA M, et al. Efficient decomposition of perfluorocarboxylic acids and alternative fluorochemical surfactants in hot water[J]. Environmental Science & Technology, 2008, 42(19): 7438-7443. |
| [16] |
葛德明.超重力法强化过硫酸盐体系处理染料废水[D].北京: 北京化工大学, 2015. GE D M. Treatment of dyes wastewater with sodium persulfate advanced oxidation processes intensified by a high gravity method[D]. Beijing: Beijing University of Chemical Technology, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10010-1015724942.htm |
| [17] |
LIANG C J, HUANG C F, CHEN Y J. Potential for activated persulfate degradation of BTEX contamination[J]. Water Research, 2008, 42(15): 4091-4100. DOI:10.1016/j.watres.2008.06.022 |








