天然产物,特别是植物的次级代谢产物,由于具有抗疟疾、抗凝血、抗肿瘤、抗氧化、抗衰老和消炎等一系列生物活性,常被用于药品、营养品和化妆品等的生产[1-4]。在中草药中,存在许多具有良好药理活性的天然产物,如红豆杉中的紫杉醇[5],黄花蒿茎叶中的青蒿素[6]和红景天中的红景天苷[7]。然而,纯天然产物实际的人体利用效果并不显著,主要原因是天然产物特殊的化学结构使其稳定性、水溶性不高,进而导致生物利用率较低。为了有效解决这一问题,目前多利用糖基化、甲基化、羟基化和异戊烯化反应来提高天然产物结构的复杂性和多样性。其中,糖基化反应是应用最为广泛的一类化学反应,它利用糖基转移酶使糖和天然产物之间形成特定的糖苷键来合成糖苷类化合物[8-10]。Thuan等[11]在杨梅素的3-OH上连接一个鼠李糖进而生成的杨梅素-3-O-α-L-鼠李糖苷,大大增加了杨梅素的生物活性;Stahlhut等[12]发现在培养基中所加入的槲皮素不稳定且会在24 h内完全降解,而在槲皮素上引入葡萄糖基团所生成的异苷48 h后依然可以在培养基中稳定地存在,说明槲皮素形成糖苷类化合物后其稳定性显著提高;甜菊苷是一种带有轻微的薄荷醇苦味及一定程度涩味的天然产物,在Li等[13]的研究中,甜菊苷经过单糖基化或双糖基化后的产物甜度都得到了提高。上述文献报道均证明糖苷类化合物较原始天然产物的生物活性都得到了很大的提高。目前利用糖基转移酶合成糖苷类化合物的研究已经取得了一定的进展[14],本文就近年来利用不同来源的糖基转移酶合成糖苷类化合物的研究进行综述和展望,为以后的深入研究和工业化生产奠定基础。
1 糖基转移酶糖基转移酶(GTs)能催化特定的糖和受体之间形成糖苷键,其催化的底物是一系列的生物分子,包括糖、蛋白质、脂质及其他小分子[15-16];最常见的糖供体是经过活化的核苷酸糖,较少见的是磷酸脂连接的糖[17]。糖基转移酶是一个多成员的基因家族,根据其氨基酸序列的相似性、底物特异性、反应机制和三维结构,糖基转移酶被分为97个家族(GT1~GT97),其中GT1是含有糖基转移酶数量最多的家族[18-19]。
根据催化特性,糖基转移酶分为Leloir型和non-Leloir型。Leloir型的糖基转移酶以活化的核苷酸糖为糖基供体,如尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDP-葡萄糖)、尿苷二磷酸半乳糖(uridine diphosphate galactose,UDP-半乳糖)及尿苷二磷酸鼠李糖(uridine diphosphate rhamnose,UDP-鼠李糖)等[15, 20-21];Leloir型糖基转移酶的催化机制可以分为保留型和反转型,其中利用保留型的糖基转移酶发生糖基化反应后糖供体的构型不会发生改变,而利用反转型的糖基转移酶发生糖基化反应后糖基供体会由α型变为β型[22-23]。non-Leloir型的糖基转移酶则以磷酸脂连接的糖为糖基供体,如蔗糖、淀粉及其水解产物等[24]。
Fedoroff等[25]于1984年第一次鉴定了参与植物次级代谢的糖基转移酶——来自于玉米的黄酮醇-3-O-葡糖基转移酶,随后Hughes等[26]发现了涉及植物次级代谢糖基转移酶的保守序列,其由靠近蛋白C-端的约40个氨基酸组成,称为PSPG盒。在此之后新发现的很多植物糖基转移酶都含有PSPG盒的序列,说明该段序列能为鉴定未知酶是否属于糖基转移酶提供参考,因此PSPG盒保守序列对识别糖基转移酶具有十分重要的意义[27-28]。
2 糖基转移酶合成糖苷类化合物 2.1 背景介绍目前,糖苷类化合物主要通过3种不同的方式获得:从天然植物中提取、化学合成和酶法合成[29-31]。从天然植物中提取糖苷类化合物的工艺复杂,而且天然植物中糖苷类化合物的含量低,提取成本较高。化学合成的方法在生产过程中所使用的试剂及产生的副产物大多对环境有污染,无法实现环境可持续性,因此近年来酶法合成糖苷类化合物受到了越来越多的关注。酶法合成糖苷类化合物的重点是对于糖基转移酶的选择,目前已有很多关于利用糖基转移酶合成糖苷类化合物的研究,其中糖基转移酶可以分为植物来源的糖基转移酶和微生物来源的糖基转移酶两大类群。由糖基转移酶合成的一些糖苷类化合物如红景天苷、天麻素及熊果苷等的结构式如图 1所示。
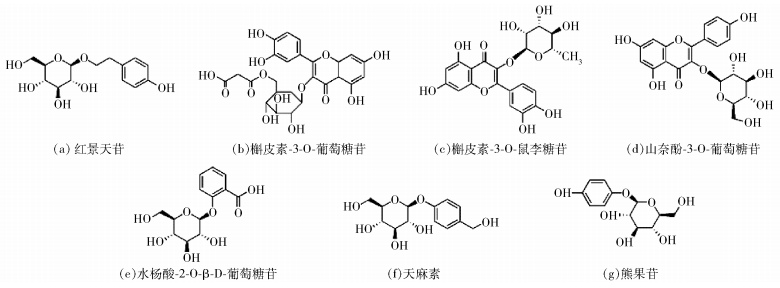
|
图 1 糖苷类化合物结构式 Fig.1 The structural formula of glycosides |
作为一种模式植物,拟南芥含有众多的糖基转移酶,因此拟南芥中的糖基转移酶是目前研究最多的一类酶,拟南芥为十字花科植物,又名鼠耳芥、阿拉伯芥。An等[32]使大肠杆菌表达出了来自拟南芥的糖基转移酶AtUGT78D2和AtUGT79B1。其中糖基转移酶AtUGT78D2利用UDP-葡萄糖将槲皮素催化为槲皮素-3-O-葡萄糖苷,然后在糖基转移酶AtUGT79B1的作用下,以UDP-木糖苷为糖供体、槲皮素-3-O-葡萄糖苷为底物合成了65 mg/L槲皮素-3-O-葡萄糖基(1→2)木糖苷。Kim等[33]将dTDP-4-脱氢鼠李糖还原酶和拟南芥中的糖基转移酶AtUGT78D1的基因在大肠杆菌中共表达,分别以槲皮素和山奈酚为底物、TDP-鼠李糖为糖供体合成了槲皮素-3-O-鼠李糖苷和山奈酚-3-O-鼠李糖苷,并发现糖基转移酶AtUGT78D1还能以UDP-鼠李糖为糖供体;在此基础上向大肠杆菌中引入来自拟南芥的鼠李糖合酶RHM2,将UDP-葡萄糖转化成UDP-鼠李糖,合成了150 mg/L槲皮素-3-O-鼠李糖苷和200 mg/L山奈酚-3-O-鼠李糖苷。Thuan等[34]也在大肠杆菌中表达出了拟南芥中的糖基转移酶AtUGT78D1,以TDP-鼠李糖为糖供体、花旗松素为底物实现了落新妇苷的合成,其产量为(22.3±0.5) mg/L;研究人员在大肠杆菌中强化了TDP-鼠李糖合成途径,且通过敲除葡萄糖-6-磷酸异构酶基因(pgi)和葡萄糖-6-磷酸脱氢酶基因(zwf)来阻断葡萄糖-6-磷酸的降解途径,增加TDP-鼠李糖合成前体葡萄糖-6-磷酸的供给,使落新妇苷的转化率达到了(33.5±1.3)%。Bruyn等[35]将拟南芥中的糖基转移酶基因RhaGT和UDP-鼠李糖合酶基因MUM4(将UDP-葡萄糖转化成UDP-鼠李糖)导入大肠杆菌中,以UDP-鼠李糖为糖供体、槲皮素为底物合成了槲皮素-3-O-鼠李糖苷,产量达到了1.12 g/L。Han等[36]筛选了来自拟南芥的12个葡萄糖基转移酶,其中糖基转移酶AtUGT71C1和AtUGT72E2在引入大肠杆菌后,能以大肠杆菌内源的UDP-葡萄糖为糖供体、阿魏酸为底物分别合成阿魏酰葡萄糖苷和阿魏酸葡萄糖苷;利用糖基转移酶AtUGT71C1合成的阿魏酰葡萄糖苷的转化率为1.8 μmol/(L·h),利用糖基转移酶AtUGT72E2合成的阿魏酸葡萄糖苷的转化率可达15.8 μmol/(L·h)。Ahmadi等[37]在大肠杆菌中构建了一条合成水杨酸的途径,并通过在大肠杆菌中表达来自拟南芥的糖基转移酶UGT74F1,以水杨酸为底物、UDP-葡萄糖为糖供体合成了2.5 g/L水杨酸-2-O-β-D-葡萄糖苷。Xia等[38]在大肠杆菌中表达来自拟南芥的糖基转移酶UGT73B3和UGT84B1,分别以槲皮素为底物、UDP-葡萄糖为糖供体合成槲皮素-3-O-葡萄糖苷和槲皮素-7-O-葡萄糖苷;通过温度的优化实验,发现糖基转移酶UGT73B3在33 ℃时催化合成的槲皮素-3-O-葡萄糖苷产量最高,达到了330 mg/L,另一个糖基转移酶UGT84B1在37 ℃时催化合成的槲皮素-7-O-葡萄糖苷产量最高,达到了95 mg/L。因此,通过温度优化来提高酶活是提高产量的有效办法。
大豆为一年生草本豆科类植物,是中国的主要粮食作物之一。近年来的研究表明,大豆中也有很多可用于合成糖苷类化合物的糖基转移酶。Shrestha等[39]在大肠杆菌中引入外源基因葡萄糖激酶glk、葡萄糖磷酸变位酶pgm2和葡萄糖-1-磷酸尿苷酰转移酶galU,强化了UDP-葡萄糖合成途径;并在大肠杆菌中表达来自大豆的糖基转移酶GtUF6CGT1,分别以白杨素和木犀草素为底物,合成了14 mg/L白杨素-6-C-葡萄糖苷和34 mg/L木犀草素-6-C-葡萄糖苷。Malla等[40]在大肠杆菌中表达了来自拟南芥的黄烷酮-3-羟化酶(f3h)和黄烷酮合酶(fls1)的外源基因,将柚皮素转化为山奈酚;又在大肠杆菌中表达了大豆中的糖基转移酶UGT78K1,以UDP-葡萄糖为糖供体、以山奈酚为底物合成了109.3 mg/L山奈酚-3-O-葡萄糖苷。Rojas等[41]成功鉴定了大豆糖基转移酶基因,将糖基转移酶命名为GmF3G6″Gt;研究人员对糖基转移酶GmF3G6″Gt的功能进行分析,利用该基因构建载体后在大肠杆菌中表达,得到重组蛋白后提纯并检测其活性,发现糖基转移酶GmF3G6″Gt以UDP-葡萄糖为糖供体时,可催化山奈酚-3-O-葡萄糖苷转化为山奈酚-3-O-葡萄糖基(1→6)-葡萄糖苷。
其他植物中也存在着能合成糖苷类化合物的糖基转移酶。Bai等[42]在大肠杆菌中表达了丙酮酸脱羧酶基因ARO10,并利用大肠杆菌内源的醇脱氢酶ADH将合成酪氨酸途径中的4-羟苯基丙酮酸转化成酪醇;在此基础上表达来自红景天的糖基转移酶UGT73B6,以UDP-葡萄糖为糖供体、酪醇为底物合成了56.9 mg/L红景天苷。后来研究人员又发现,将红景天糖基转移酶UGT73B6的第389位苯丙氨酸突变为丝氨酸,可得到新的糖基转移酶UGT73B6FS,其能以UDP-葡萄糖为糖供体、4-羟基苯甲醇为底物合成545 mg/L天麻素[43]。Shen等[1]在大肠杆菌中构建了一条从葡萄糖合成氢醌的途径,再通过在大肠杆菌中表达来自蛇根木的糖基转移酶AS,以氢醌为底物、UDP-葡萄糖为糖供体合成了4.19 g/L熊果苷。植物来源的用以合成糖苷类化合物的总结见表 1。
| 下载CSV 表 1 植物来源的用以合成糖苷类化合物的糖基转移酶 Table 1 Synthesis of glycosides using glycosyltransferases from plant |
除了植物来源的糖基转移酶,近年来也发现很多来源于微生物的糖基转移酶可以合成糖苷类化合物。枯草芽孢杆菌是一种革兰氏阳性好氧细菌。Liang等[44]发现枯草芽孢杆菌中的糖基转移酶UGT109A1可催化人参皂苷的C3-OH、C12-OH和C20-OH糖基化产生非天然人参皂苷,他们将糖基转移酶UGT109A1的基因引入酵母中,以达玛烯二醇Ⅱ(DM)、原人参二醇(PPD)和原人参三醇(PPT)为底物,实现了3β-O-Glc-DM、3β, 20S-Di-O-Glc-DM、3β, 12β-Di-O-Glc-PPD和3β, 12β-Di-O-Glc-PPT共4种非天然人参皂苷的合成;研究人员通过进一步研究3β, 12β-Di-O-Glc-PPD的抗肺癌活性,发现相比于活性最高的天然人参皂苷Rg3、3β, 12β-Di-O-Glc-PPD在低于Rg3浓度时显示出更高的抗肺癌活性;通过在酵母中分别引入糖基转移酶UGT109A1、人参脱甲酰壳多糖合成酶DS、人参细胞色素P450型原人参二醇合酶PPDS和拟南芥NADPH-细胞色素P450还原酶ATR1的基因, 合成了6.17 mg/L 3β, 12β-Di-O-Glc-PPD;为了增加其前体2, 3-氧化四氢叶酸的供给,研究人员还将tHMG1引入酵母中,使3β, 12β-Di-O-Glc-PPD的产量提高到了9.05 mg/L。
地衣芽孢杆菌是一种常见于土壤中的革兰氏阳性嗜热细菌。Pandey等[45]发现了来自地衣芽孢杆菌DSM13的UDP-糖基转移酶YjiC可在体外作用于23种类黄酮,产生多种糖苷类化合物。Pandey等[46]还发现糖基转移酶YjiC能以UDP-α-D-半乳糖、TDP-α-L-鼠李糖、GDP-α-L-岩藻糖和TDP-α-D-2-脱氧葡萄糖为糖供体,说明糖基转移酶YjiC具有广泛的底物选择范围;随后研究人员通过敲除大肠杆菌BL21(DE3)的葡萄糖磷酸异构酶pgi、葡萄糖-6-磷酸脱氢酶zwf和尿苷酰转移酶galU基因,并在大肠杆菌BL21(DE3)中构建了从葡萄糖合成4种不同dTDP-脱氧糖(TDP-L-鼠李糖,TDP-4-氨基-4, 6-二脱氧-D-半乳糖,TDP-D-viosamine和TDP-3-氨基-3, 6-二脱氧-D-半乳糖)的途径,为糖基转移酶YjiC提供糖供体。在改造后的大肠杆菌中表达了糖基转移酶YjiC的基因,发现在大肠杆菌中只能以TDP-L-鼠李糖为糖供体、3-羟基黄酮为底物合成3-羟基黄酮-3-O-鼠李糖苷。最近Luan等[47]通过在大肠杆菌中表达糖基转移酶YjiC,以伞形酮为底物合成了323 mg/L茵芋苷。
蜡样芽孢杆菌是一种革兰氏阳性菌。来自蜡样芽孢杆菌的糖基转移酶BcGT1能分别催化槲皮素、山奈酚与杨梅黄酮发生糖基化反应。糖基转移酶BcGT1具有广泛的底物特异性,比如以槲皮素为底物可以合成槲皮素-3-O-葡萄糖苷、槲皮素-7-O-葡萄糖苷和槲皮素-4’-O-葡萄糖苷。Chiu等[48]运用蛋白质工程将糖基转移酶BcGT1的第240位苯丙氨酸突变为丙氨酸,突变后的糖基转移酶对槲皮素葡萄糖基化的区域选择性显著提高,但催化效率只有原来的25%;研究人员在将糖基转移酶BcGT1的第240位苯丙氨酸突变为丙氨酸的基础上,对第132和138位的苯丙氨酸也进行了突变,形成的多种突变后的酶使催化效率恢复到原始酶的57%~103%。微生物来源的用以合成糖苷类化合物的糖基转移酶总结如表 2所示。
| 下载CSV 表 2 微生物来源的用以合成糖苷类化合物的糖基转移酶 Table 2 Synthesis of glycosides using glycosyltransferases from microorganisms |
综上所述,以天然产物为底物,利用不同来源的糖基转移酶合成糖苷类化合物的研究有很多。随着代谢工程[49]和蛋白质工程[50]的不断发展,将糖基转移酶运用于“细胞工厂”生产糖苷类化合物成为研究的热点,如天麻素和熊果苷在大肠杆菌中的从头合成[43, 1];但是糖基转移酶是一种多基因家族酶,其底物灵活性和庞大的种类数量都成为研究糖基转移酶合成糖苷类化合物的难点;因此利用蛋白质工程对糖基转移酶进行系统的改造以使其具有理想的催化特性,是利用糖基转移酶合成糖苷类化合物的一个重要研究手段。同时,由于糖基转移酶的灵活性,有些糖基转移酶能将糖供体转移到不同的结构相似的糖基受体上,利用这一特点可催化形成新型糖苷类化合物。尽管目前合成糖苷类化合物的工业化应用还处于起始阶段,但是可以预见,通过糖基转移酶合成糖苷类化合物将成为未来合成糖苷类化合物工业化利用的主力军。
团队简介
袁其朋教授团队是教育部长江学者创新团队、“111”引智基地团队及北京化工大学双一流学科建设团队,长期从事植物天然活性成分分离及合成生物学领域的研究工作。主要科研成果包括:研制了植物天然活性成分规模制备的设备及专用分离介质,开展系统集成创新研究,提升了植提行业水平;发展了酶转化前提物生产天然产物技术,揭示酶催化转化原理,挖掘新酶,建立绿色生产工艺,实现工业生产;从途径设计创建、代谢网络改造、底盘细胞构建等多层次开展研究,建立大肠杆菌合成生物学平台,高效合成高附加值产物。团队成员共负责国家“863”计划5项,国家重点研发任务1项、国家自然科学基金11项、国家国际科技合作专项2项、北京市教委及科委项目2项、香港创新工业署项目5项及多项企业合作课题;发表SCI论文300余篇(引用6 020余次),申请PCT专利4项(授权1项)、中国发明专利90项(授权48项);获国家科技进步二等奖1项、省部级科技进步一等奖2项及二等奖2项。多项成果实现工业化生产,创造了良好的经济效益。
| [1] |
SHEN X L, WANG J, WANG J, et al. High-level de novo biosynthesis of arbutin in engineered Escherichia coli[J]. Metabolic Engineering, 2017, 42: 52-58. DOI:10.1016/j.ymben.2017.06.001 |
| [2] |
PADDON C J, WESTFALL P J, PITERA D J, et al. High-level semi-synthetic production of the potent antimalarial artemisinin[J]. Nature, 2013, 496(7446): 528-532. DOI:10.1038/nature12051 |
| [3] |
WANG J, SHEN X L, REY J, et al. Recent advances in microbial production of aromatic natural products and their derivatives[J]. Applied Microbiology & Biotechnology, 2017, 102(4): 1-15. |
| [4] |
SHEN X L, WANG J, GALL B, et al. Establishment of novel biosynthetic pathways for the production of salicyl alcohol and gentisyl alcohol in engineered Escherichia coli[J]. ACS Synthetic Biology, 2018, 7: 1012-1017. DOI:10.1021/acssynbio.8b00051 |
| [5] |
LEE C G, KIM J H. A kinetic and thermodynamic study of fractional precipitation of paclitaxel from taxus chinensis[J]. Process Biochemistry, 2017, 59: 216-222. DOI:10.1016/j.procbio.2017.05.016 |
| [6] |
SHEN Q, ZHANG L D, LIAO Z H, et al. The genome of artemisia annua provides insight into the evolution of asteraceae family and artemisinin biosynthesis[J]. Molecular Plant, 2018, 11(6): 776-788. DOI:10.1016/j.molp.2018.03.015 |
| [7] |
TORRENS-SPENCE M P, PLUSKAL T, LI F S, et al. Complete pathway elucidation and heterologous reconstitution of Rhodiola salidroside biosynthesis[J]. Molecular Plant, 2018, 11(1): 205-217. DOI:10.1016/j.molp.2017.12.007 |
| [8] |
HARTL K, MCGRAPHERY K, RUDIGER J, et al. Tailoring natural products with glycosyltransferases[M]//SCHWAB W, LANGE B M, WVST M. Biotechnology of natural products. Berlin: Springer, 2018.
|
| [9] |
PARAJULI P, PANDEY R P, NGUYEN T, et al. Substrate scope of O-methyltransferase from streptomyces peucetius for biosynthesis of diverse natural products methoxides[J]. Applied Biochemistry & Biotechnology, 2018, 184(4): 1404-1420. |
| [10] |
ZHU N B, ZHAO J G, BAO H L. Iron catalyzed methylation and ethylation of vinyl arenes[J]. Chemical Science, 2016, 8(3): 2081-2085. |
| [11] |
THUAN N H, PANDEY R P, THUY T T, et al. Improvement of regio-specific production of myricetin-3-O-α-l-rhamnoside in engineered Escherichia coli[J]. Applied Biochemistry and Biotechnology, 2013, 171(8): 1956-1967. DOI:10.1007/s12010-013-0459-9 |
| [12] |
STAHLHUT S G, SIEDLER S, MALLA S, et al. Assembly of a novel biosynthetic pathway for production of the plant plavonoid pisetin in Escherichia coli[J]. Metabolic Engineering, 2015, 31: 84-93. DOI:10.1016/j.ymben.2015.07.002 |
| [13] |
LI S, LI W, XIAO Q Y, et al. Transglycosylation of stevioside to improve the edulcorant quality by lower substitution using cornstarch hydrolyzate and cgtase[J]. Food Chemistry, 2013, 138(2/3): 2064-2069. |
| [14] |
HUANG G, MEI X. Synthetic glycosylated natural pro-ducts have satisfactory activities[J]. Current Drug Targets, 2014, 15(8): 780-784. |
| [15] |
XU L J, QI T T, XU L, et al. Recent progress in the enzymatic glycosylation of phenolic compounds[J]. Journal of Carbo-hydrate Chemistry, 2016, 35(1): 1-23. DOI:10.1080/07328303.2015.1137580 |
| [16] |
WAGNER G K, PESNOT T. Glycosyltransferases and their assays[J]. Chembiochem, 2010, 11(14): 1939-1949. DOI:10.1002/cbic.v11:14 |
| [17] |
GLOSTER T M. Advances in understanding glycosyltransferases from a structural perspective[J]. Current Opinion in Structural Biology, 2014, 28: 131-141. DOI:10.1016/j.sbi.2014.08.012 |
| [18] |
TIWARI P, SANGWAN R S, SANGWAN N S. Plant secondary metabolism linked glycosyltransferases:an update on expanding knowledge and scopes[J]. Biotechnology Advances, 2016, 34(5): 714-739. DOI:10.1016/j.biotechadv.2016.03.006 |
| [19] |
RINI J, EAKO J, VARKI A. Glycosyltransferases and glycanprocessing enzymes[M]//VARKI A, CUMMINGS R D, ESKO J D, et al. Essentials of glycobiology. New York: The Cold Spring Harbor Laboratory Press, 2009.
|
| [20] |
BUNGARUANG L, GUTMANN A, NIETZKY B. Leloir glycosyltransferases and natural product glycosylation:biocatalytic synthesis of the C-glucoside nothofagin, a major antioxidant of redbush herbal tea[J]. Advanced Synthesis & Catalysis, 2013, 355(14/15): 2757-2763. |
| [21] |
SEIBEL J, BEINE R, MORARU R, et al. A new pathway for the synthesis of oligosaccharides by the use of non-Leloir glycosyltransferases[J]. Biocatalysis and Biotransformation, 2015, 24(1/2): 157-165. |
| [22] |
HANCOCK S M, VAUGHAN M D, WITHERS S G. Engineering of glycosidases and glycosyltransferases[J]. Current Opinion in Chemical Biology, 2006, 10(5): 509-519. |
| [23] |
VLIST J V D, LOOS K. Transferases in polymer chemistry[J]. Advances in Polymer Science, 2011, 237(2): 21-54. |
| [24] |
PLOU F J, MARTIN M T, SEGURA A G D, et al. Glucosyltransferases acting on starch or sucrose for the synthesis of oligosaccharides[J]. Canadian Journal of Chemistry, 2002, 80(6): 743-752. DOI:10.1139/v02-104 |
| [25] |
FEDOROFF N V, FURTEK D B, NELSON O E. Cloning of the bronze locus in maize by a simple and generalizable pocedure using the transposable controlling element activator (ac)[J]. Proc Nati Acad Sci USA, 1984, 81(12): 3825-3829. DOI:10.1073/pnas.81.12.3825 |
| [26] |
HUGHES J, HUGHES M A. Multiple secondary plant product UDP-glucose glucosyltransferase genes expressed in cassava (Manihot esculenta Crantz) cotyledons[J]. DNA Sequence, 1994, 5(1): 41-49. DOI:10.3109/10425179409039703 |
| [27] |
SHAO H, HE X, ACHNINE L, et al. Crystal structures of a multifunctional triterpene/flavonoid glycosyltransfer-ase from Medicago truncatula.[J]. Plant Cell, 2005, 17(11): 3141-3154. |
| [28] |
HAYWARD A P, MORENO M A, HOWARD R T, et al. Control of sexuality by the skl-encoded UDP-glycosyltransferase of Maize[J]. Science Advances, 2016, 2(10): e1600991. DOI:10.1126/sciadv.1600991 |
| [29] |
LI L, LIU C M, LIU Z Q, et al. Isolation and purification of phenylethanoid glycosides from plant extract of Plantago asiatica by high performance centrifugal partition chromatography[J]. Chinese Chemical Letters, 2008, 19(11): 1349-1352. DOI:10.1016/j.cclet.2008.09.002 |
| [30] |
ATI J, LAFITE P, DANIELLOU R. Enzymatic synthesis of glycosides:from natural O-and N-glycosides to rare C-and S-glycosides[J]. Beilstein Journal of Organic Chemistry, 2017, 13(1): 1857-1865. |
| [31] |
GALLO M, VITULANO M, ANDOLFI A, et al. Rapid solid-liquid dynamic extraction (rslde):a new rapid and greener method for extracting two steviol glycosides (stevioside and rebaudioside A) from stevia leaves[J]. Plant Foods for Human Nutrition, 2017, 72(2): 1-8. |
| [32] |
AN D G, YANG S M, KIM B G, et al. Biosynthesis of two quercetin O-diglycosides in Escherichia coli[J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43(6): 841-849. |
| [33] |
KIM B G, KIM H J, AHN J H. Production of bioactive flavonol rhamnosides by expression of plant genes in Escherichia coli[J]. Journal of Agricultural & Food Chemistry, 2012, 60(44): 11143-11148. |
| [34] |
THUAN N H, MALLA S, TRUNG N T, et al. Microbial production of astilbin, a bioactive rhamnosylated flavanonol, from taxifolin[J]. World Journal of Microbiology & Biotechnology, 2017, 33(2): 36. |
| [35] |
BRUYN F D, BREMPT M V, MAERTENS J, et al. Metabolic engineering of Escherichia coli into a versatile glycosylation platform:production of bio-active quercetin glycosides[J]. Microbial Cell Factories, 2015, 14(1): 138. DOI:10.1186/s12934-015-0326-1 |
| [36] |
HAN D Y, LEE H R, KIM B G, et al. Biosynthesis of ferulic acid 4-O-glucoside and feruloyl glucoside using Escherichia coli harboring regioselective glucosyl transferases[J]. Applied Biological Chemistry, 2016, 59(3): 481-484. DOI:10.1007/s13765-016-0186-3 |
| [37] |
AHMADI M K, FANG L, MOSCATELLO N, et al. E. coli metabolic engineering for gram scale production of a plant-based anti-inflammatory agent[J]. Metabolic Engineering, 2016, 38: 382-388. DOI:10.1016/j.ymben.2016.10.001 |
| [38] |
XIA T, EITEMAN M A. Quercetin glucoside production by engineered Escherichia coli[J]. Appl Biochem Biotechnol, 2017, 182(4): 1358-1370. DOI:10.1007/s12010-017-2403-x |
| [39] |
SHRESTHA A, PANDEY R P, DHAKAL D, et al. Biosynthesis of flavone C-glucosides in engineered Escherichia coli[J]. Applied Microbiology & Biotechnology, 2018, 102(3): 1251-1267. |
| [40] |
MALLA S, PANDEY R P, KIM B G, et al. Regiospecific modifications of naringenin for astragalin production in Escherichia coli[J]. Biotechnology & Bioengineering, 2013, 110(9): 2525-2535. |
| [41] |
ROJAS R F, DI S, MURAI Y, et al. Cloning and characterization of soybean gene Fg1 encoding favonol 3-O-glucoside/galactoside (1→6) glucosyltransferase[J]. Plant Molecular Biology, 2016, 92(4): 1-12. |
| [42] |
BAI Y F, BI H P, ZHUANG Y, et al. Production of salidroside in metabolically engineered Escherichia coli[J]. Scientific Reports, 2014, 4(55): 6640. |
| [43] |
BAI Y F, YIN H, BI H P, et al. De novo biosynthesis of gastrodin in Escherichia coli[J]. Metabolic Engineering, 2016, 35: 138-147. DOI:10.1016/j.ymben.2016.01.002 |
| [44] |
LIANG H C, HU Z F, ZHANG T, et al. Production of a bioactive unnatural ginsenoside by metabolically engineered yeasts based on a new UDP-glycosyltransferase from Bacillus subtilis[J]. Metabolic Engineering, 2017, 44: 60-69. DOI:10.1016/j.ymben.2017.07.008 |
| [45] |
PANDEY R P, GURUNG R B, PARAJULI P, et al. Assessing acceptor substrate promiscuity of Yjic-mediated glycosylation toward flavonoids[J]. Carbohydrate Research, 2014, 393(1): 26-31. |
| [46] |
PANDEY R P, PARAJULI P, GURUNG R B, et al. Donor specificity of Yjic glycosyltransferase determines the conjugation of cytosolic NDP-sugar in vivo glycosylation reactions[J]. Enzyme & Microbial Technology, 2016, 91: 26-33. |
| [47] |
LUAN L C, PANDEY R P, LIM H N, et al. Synthesis of umbelliferone derivatives in Escherichia coli and their biological activities[J]. Journal of Biological Engineering, 2017, 11(1): 15. DOI:10.1186/s13036-017-0056-5 |
| [48] |
CHIU H H, HSIEH Y C, CHEN Y H, et al. Three important amino acids control the regioselectivity of flavonoid glucosidation in glycosyltransferase-1 from Bacillus cereus[J]. Appl Microbiol Biotechnol, 2016, 100(19): 8411-8424. DOI:10.1007/s00253-016-7536-2 |
| [49] |
ABERNATHY M H, LIAN H, TANG Y J. Channeling in native microbial pathways:implications and challenges for metabolic engineering[J]. Biotechnology Advances, 2017, 35(6): 805-814. DOI:10.1016/j.biotechadv.2017.06.004 |
| [50] |
ALCALDE M. Directed enzyme evolution: advances and applications[M]. Berlin: Springer International Publishing, 2017.
|








