2. 北京化工大学 北京软物质科学与工程高精尖创新中心, 北京 100029
2. Beijing Advanced Innovation Center for Soft Matter Science and Engineering, Beijing University of Chemical Technology, Beijing 100029, China
纤维素类物质含有难以生物降解的木质素,是这类物质开发使用的瓶颈[1]。木质纤维素中含有40%~50%的纤维素、25%~35%的半纤维素(己糖和木糖的杂聚物)和15%~20%的木质素,是世界上最丰富的生物质资源。在木质纤维素的水解液中,葡萄糖含量最高,其次是木糖。葡萄糖作为底物用来发酵产氢已得到了深入研究。
然而,由于可以有效利用木糖的微生物有限,木糖作为底物发酵产氢的报道较少。因此,要经济有效地将木质纤维素转化成能源物质,需要筛选木糖高效降解菌。Goshima等[2]利用Kluyveromyces marxianus发酵木糖产乙醇和木糖醇,在30 ℃时得到最大乙醇产率为每g木糖产生(0.187±0.010)g乙醇,在42 ℃时得到最大木糖醇产率为每g木糖产生(0.568±0.015) g木糖醇。Lo等[3]筛选出一株单菌Clostridium butyricum CGS5,可以以木糖为底物发酵产氢,得到的产氢得率为0.73(1 mol木糖产生的氢气的摩尔数)。任云利等[4]以木糖为底物, 研究了不同预处理方式对产氢效果的影响,实验结果表明,在100 ℃热处理10 min条件下得到最大产氢量为每80 mL发酵液产生312 mL H2,最大产氢速率为22 mL/h,较未处理的活性污泥分别提高133%和50%。
由于纤维素水解液中各种抑制物的存在,对微生物的生长造成了一定的影响[5],所以利用纤维素水解液高效产氢仍面临很大困难。由此可见,利用木糖进行发酵产氢虽然取得了一定的进展,但是目前其效率一般比较低,而且产氢速率比较慢,主要原因是缺少高效木糖产氢菌。
相比于单一菌种,微生物菌群拥有更多元化的基因库,更多样化的代谢途径, 因此微生物菌群可以利用更加复杂、低值的生物质,从而获得比单一菌种更高的生物转化效率[6-8]。然而由于天然菌群活性较低,菌群结构不可控,人们开始尝试构建更加高效与适配的人工多细胞体系。Zhang等[9]通过设计构建了人工双细胞系统生产粘康酸和对羟基苯甲酸,从而降低了单菌合成的生物负荷。为减少单一细胞的代谢压力或生物负荷,一些生物功能可以分成多个不同的单独优化的过程,通过多个细胞体系来完成,此类工作越来越引起研究者的重视。
为了使得纤维素类物质能够得到完全利用,本文利用自主筛选的蜡样芽胞杆菌Bacillus cereus (CP015727) (A1)和短波单胞菌属Brevumdimonas naejangsanensis (CP015614)(B1)构建人工双细胞体系,考察了单菌发酵和混合发酵对木糖的利用效果以及双细胞体系协同产氢特性。
1 实验部分 1.1 实验材料和仪器 1.1.1 实验材料牛肉膏、蛋白胨,北京奥博星生物技术有限公司;氯化钠、氢氧化钠、盐酸、酒石酸钾钠、苯酚、葡萄糖、KH2PO4、K2HPO4、乙酸,北京化工厂;正丁酸,天津市光复精细化工研究所;3, 5-二硝基水杨酸,天津市津科精细化工研究所;酚酞,天津市福晨化学试剂厂;琼脂糖,Gene Tech(Shanghai) Co. Ltd.;木糖,Life Science Product & Services。
发酵菌株Bacillus cereus A1 (CP015727)和Brevumdimonas naejangsanensis B1 (CP015614)分别由本实验室筛选获得[10-11]。
1.1.2 实验仪器PHB-1便携式pH计,上海三信仪表厂;超净工作台,上海新苗医疗器械制造有限公司;生化培养箱,上海精宏实验设备有限公司;磁力搅拌恒温水浴锅,金坛市华峰仪器有限公司;GC-2010气相色谱仪,日本岛津;紫外可见分光光度计,上海光谱仪器有限公司。
1.2 实验装置分别将保存的A1、B1菌液以体积比1:100接入种子培养基,生化培养箱37 ℃条件下培养3 d后,转移至发酵培养基。
批次实验装置为1.25 L玻璃瓶,其中发酵液为1.0 L。培养体系发酵培养基体积为0.8 L,两株菌按照相应比例共接种200 mL。接种完毕后用胶塞密封瓶口,并向装置内通入氩气5 min以排净空气保证厌氧环境。发酵过程在恒温水浴锅中进行,体系温度维持在35 ℃。
1.3 培养基种子培养基(质量分数,下同):牛肉浸粉0.3%;蛋白胨1%;NaCl 0.5%。发酵培养基:木糖1%;蛋白胨0.2%;NaCl 0.5%。
1.4 不同过程参数的测定方法 1.4.1 pH监测根据发酵状态,利用PHB-1便携式pH计测定特定时段发酵液的pH。
1.4.2 气体体积以及组分分析利用排水法测量气体体积,气相色谱测定气体组分。
气相色谱仪填充柱为TDX-01不锈钢柱,载气为氩气。温度设定为:液相进样口160 ℃,柱温160 ℃,TCD检测器180 ℃。65 r/min恒流泵进样。
氢气累积量测定公式如式(1)
| $ {V_{{{\rm{H}}_2},i}} = {V_{{{\rm{H}}_2},i - 1}} + {V_{\rm{w}}}{C_{{{\rm{H}}_2},i}} + {V_{{\rm{R}},i}}{C_{{{\rm{H}}_2},i}} - {V_{{\rm{R}},i - 1}}{C_{{{\rm{H}}_2},i - 1}} $ | (1) |
式中,VH2, i和VH2, i-1分别表示发酵i及i-1时的累计产氢量,mL;Vw表示总产气体积,mL;CH2, i表示发酵i时段所产气体中的氢气(体积分数),%;VR, i和VR, i-1表示反应器上部残留气体体积,mL。
1.4.3 木糖浓度发酵液稀释25倍后即取1 mL发酵液在容量瓶中定容至25 mL。充分混合后,吸取1 mL容量瓶中液体于试管中,加入1 mL 3, 5-二硝基水杨酸(DNS)试剂,摇匀后放入沸水浴,反应5 min后立即冷却体系以终止反应。加去离子水至10 mL,混匀后利用紫外分光光度计在540 nm波长下测量吸光度。
将得到的吸光度代入已绘制的A540 nm-cglu(xyl)标准曲线,求出对应的浓度再乘以25即为发酵液木糖浓度。
1.5 不同菌株配比的批次产氢实验培养基木糖质量浓度为10 g/L,接种量为200 mL,A1、B1菌液体积比分别设置为1:0、0:1、1:1;每个体系设置两个平行。
监测产氢过程中发酵体系累计产氢量、pH、底物含量等过程参数的变化,分析比较纯培养和混合培养菌株利用木糖发酵产氢的能力。
2 结果与讨论 2.1 纯培养和混合培养对发酵木糖累积产氢的影响发酵液(未加种子液)中底物木糖初始质量浓度为10 g/L,分别进行A1、B1的单菌培养,或按体积比1:1接入双细胞进行混菌培养发酵产氢。
从图 1可以明显看出,单菌培养时,发酵前75 h,A1与B1的产氢量差异不大;但是在75~175 h,B1单独发酵的产氢速率高于A1单独培养;发酵后期,A1的累计产氢量超过B1。相对于单菌培养,1:1混合的双细胞体系产氢速率以及最终的累积产氢量均明显提高。可能是两者之间存在一定的协同作用,使得发酵产氢的速率及累积产氢量得到了提高。
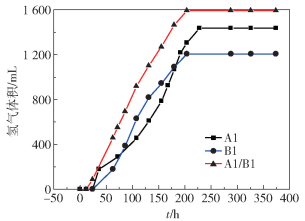
|
图 1 纯培养和混合培养发酵木糖累积产氢量的比较 Fig.1 Variation of cumulative hydrogen production with time |
计算纯培养和混合培养的氢气得率,A1、B1单独培养和混合培养的氢气得率分别为1.20、1.01和1.33。可见混合发酵的产氢速率和氢气得率均得到较大幅度的提高。利用Gompertz方程(式(2))对累计产氢曲线进行模拟,对模型中涉及的几个参数包括最大产氢潜能Pm、产氢得率以及最大产氢速率Rm进行了对比,如表 1所示。
| 下载CSV 表 1 不同接种物发酵木糖动力学模拟参数对比 Table 1 Comparison of different dynamics simulation parameters for the fermentation of xylose |
| $ {P_t} = {P_{\rm{m}}}\left\{ {{\rm{exp}}\left[ {\frac{{{R_{\rm{m}}}{\rm{e}}}}{{{P_{\rm{m}}}}}(\lambda - t) + 1} \right]} \right\} $ | (2) |
式中,Pt为培养时间t的累积产氢量,mL;Pm为最大产氢量,mL;Rm为最大产氢速率,mL/L;e为常数,数值为2.718 28;由于调整后测量的产氢数据,λ为滞后时间,h。
从表 1可以看出,A1、B1同比例混合发酵时,产氢速率最大,发酵启动较快,结合累积产氢量的区别,可以表明以木糖作为底物时,混合发酵能有效提升产氢速率,增加氢气产量,缩短发酵周期。
2.2 纯培养及混合培养对木糖含量及pH的影响木糖发酵产氢过程中的pH变化如图 2所示。单独培养B1时发酵初始pH比较低,可能是由于B1种子培养时发生了产酸反应。在发酵前40 h,B1单独发酵的pH缓慢下降,一直没有达到发酵产氢的最佳值,所以B1单独发酵产氢启动比较晚,在40 h之后才开始产气,pH随之快速下降。
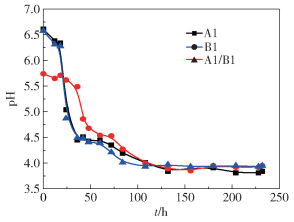
|
图 2 木糖发酵过程pH变化 Fig.2 pH changes during fermentation of xylose |
如图 3所示,A1、B1单独发酵木糖初始质量浓度分别为8.56 g/L和8.37 g/L,混合培养为7.65 g/L。混合发酵木糖利用速率以及利用率均较好,底物利用率达到96.7%。其次是菌种A1的木糖利用率,菌种B1的木糖利用率最低,只有70%左右,说明混合培养发酵促进产氢,提升了底物的利用率。
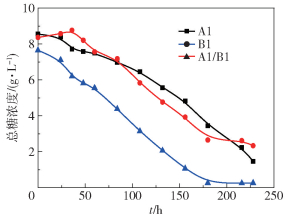
|
图 3 发酵过程木糖含量变化 Fig.3 Total sugar changes during fermentation of xylose |
B1菌种前期木糖浓度变化出现波动,与初始pH偏低有一定关系,一直到发酵体系pH恢复正常,B1底物消耗速率才有所增加。对比图 3中A1、B1两条曲线,我们发现A1(83.7%)相比于B1(74.0%)的糖利用率更高,但利用速率较慢。发酵200 h之前,B1的降解速率高于A1的降解速率,之后B1菌的代谢趋于平缓,而A1菌仍旧在进行代谢,B1发酵结束要早于A1,与产氢的变化趋势(图 1)相结合,A1菌的累积产氢量也是在200 h左右超过了B1菌的累积产氢量,说明底物的消耗速率与产氢速率的快慢存在一定的关联性。
2.3 纯培养及混合培养氢气含量变化的比较图 4是木糖发酵产氢过程中氢气含量(体积分数)的变化曲线。从图 4可以看出,氢气含量总体在50%~60%之间波动,后期逐步趋于稳定。实验组A1、B1、A1/B1的氢气的平均含量分别为51%、52%、49%,由此可见纯培养的氢气含量B1略高于A1,二者均高于混合培养的氢气含量,但是整体变化不大。文献[12]中利用木糖发酵氢气产量一般低于葡萄糖与淀粉,原因应该是木糖相对较难降解。与已报道的研究[4, 6, 13-14]相比,本文实验中的氢气含量较高,说明本文菌种利用木糖的产氢能力较好。
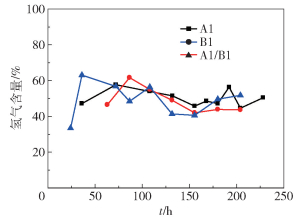
|
图 4 细菌纯培养和混合培养发酵木糖氢气含量的比较 Fig.4 Variation of hydrogen content with time |
木糖发酵产氢的代谢途径有两种类型,乙酸型发酵和丁酸型发酵,如果副产物以乙酸为主(式(3)),则最大产氢理论得率为3.33;如果副产物中丁酸居多(式(4)),则最大产氢理论得率为1.67。
| $ {\rm{3}}{{\rm{C}}_{\rm{5}}}{{\rm{H}}_{{\rm{10}}}}{{\rm{O}}_{\rm{5}}} + {\rm{5}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{5C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}} + {\rm{5C}}{{\rm{H}}_{\rm{2}}} + {\rm{10}}{{\rm{H}}_{\rm{2}}} $ | (3) |
| $ {\rm{6}}{{\rm{C}}_{\rm{5}}}{{\rm{H}}_{{\rm{10}}}}{{\rm{O}}_{\rm{5}}} \to {\rm{5C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{COOH}} + {\rm{10C}}{{\rm{O}}_{\rm{2}}} + {\rm{10}}{{\rm{H}}_{\rm{2}}} $ | (4) |
图 5显示了纯培养和混合培养发酵木糖末端产物的累积浓度,A1、B1、A1/B1发酵木糖末端产物中主要有乙酸和丁酸,丁酸的累积浓度明显高于乙酸的累积浓度,说明木糖单独及混合发酵均属于丁酸型发酵。混合发酵的丁酸浓度最高,达到3.0 g/L,其次是A1菌发酵的丁酸累积浓度。丁酸的累积与累积产氢量具有密切的关系。与文献报道的氢气得率相比[6, 13-14],本文的产氢类型属于丁酸型发酵,混合培养的产氢得率为1.33,达到了理论得率的79.6%,由此说明A1和B1同比例发酵的产氢效果较好,具有较强的木糖利用潜力。
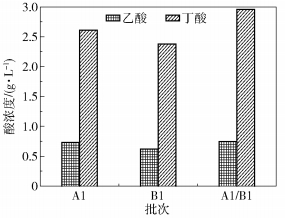
|
图 5 纯培养和混合培养末端产物的累积浓度(228 h) Fig.5 Concentration of VFAs with xylose (228 h) |
本文采用自主筛选的两株菌——蜡样芽胞杆菌A1与短波单胞菌属B1,以木糖作为底物,分别进行了A1、B1单独培养与同比例的混合培养发酵产氢特性的研究。研究结果表明,两株菌均可以利用木糖进行产氢,但与两株菌混合培养相比,产氢速率和累积产氢量明显降低;双细胞混合培养的氢气得率达到1.33,比A菌、B菌单独培养分别提高了10.8%与32.7%;同时混合发酵木糖被利用的速率以及被利用的程度均是最高的,底物利用率达到96.7%。原因可能是两株菌在代谢产氢时相互协同,从而增强了产氢效果。末端产物的种类和浓度测定结果表明,木糖发酵产氢属于丁酸型发酵。本文的研究表明,以木糖为原料,采用双细胞体系协同发酵产氢具有较大的应用潜力。
团队简介
苏海佳,北京化工大学教授,博士生导师,北京市生物加工过程重点实验室主任,杰出青年基金获得者。重点研究有机生物质材料的高值转化和新型生物材料的制备及应用,通过开发新的化学、生物方法,以可再生生物质为原料,建立低值生物质原料的功能化与环境污染物协同治理的优化途径,实现有机生物质资源的高值利用。研究领域包括环境生物技术、生物能源和环境生物材料。作为项目负责人承担国家自然科学基金、国家十一五支撑计划、国家“863”项目,国家“973”课题等国家级项目20多项。目前已发表论文130多篇,其中SCI收录80余篇;申请国家发明专利23项,授权20项。2015年获得亚洲杰出青年学者和工程师奖(日本化工学会),2012年荣获中国石油和化学工业联合会技术发明奖一等奖1项,2010年荣获高等学校科学研究优秀成果奖自然科学二等奖1项,2006年荣获北京市科技技术二等奖1项。
| [1] |
何北海, 林鹿, 孙润仓, 等. 木质纤维素化学水解产生可发酵糖研究[J]. 化学进展, 2007, 19(7): 1141-1146. HE B H, LIN L, SUN R C, et al. Chemical hydrolysis of lignocellulose to produce fermentable sugars[J]. Progress in Chemistry, 2007, 19(7): 1141-1146. (in Chinese) |
| [2] |
GOSHIMA T, NEGI K, TSUJI M, et al. Ethanol fermentation from xylose by metabolically engineered strains of Kluyveromyces marxianus[J]. Journal of Bioscience & Bioengineering, 2013, 116(5): 551-554. |
| [3] |
LO Y C, CHEN W M, HUNG C H, et al. Dark H2 fermentation from sucrose and xylose using H2-producing indigenous bacteria:feasibility and kinetic studies[J]. Water Research, 2008, 42: 827-842. DOI:10.1016/j.watres.2007.08.023 |
| [4] |
任云利, 赵爽, 王键吉. 预处理方法对活性污泥利用木糖产氢的影响[J]. 可再生能源, 2010, 28(4): 85-89. REN Y L, ZHAO S, WANG J J. Effects of pretreatment methods on hydrogen production from xylose using activated sludge[J]. Renewable Energy, 2010, 28(4): 85-89. (in Chinese) DOI:10.3969/j.issn.1671-5292.2010.04.020 |
| [5] |
戴芸芸, 钟卫鸿. 细菌降解木质纤维素的研究进展[J]. 化学与生物工程, 2016, 33(6): 11-16. DAI Y Y, ZHONG W H. Research progress of bacterial degradation of lignocellulose[J]. Chemical and Biological Engineering, 2016, 33(6): 11-16. (in Chinese) DOI:10.3969/j.issn.1672-5425.2016.06.002 |
| [6] |
QIU C, ZHENG Y, ZHENG J, et al. Mesophilic and thermophilic biohydrogen production from xylose at various initial pH and substrate concentrations with microflora community analysis[J]. Energy & Fuels, 2016, 30(2): 1013-1019. |
| [7] |
DESSÌ P, LAKANIEMI A M, LENS P N. Biohydrogen production from xylose by fresh and digested activated sludge at 37, 55 and 70℃[J]. Water Research, 2017, 115: 120-129. DOI:10.1016/j.watres.2017.02.063 |
| [8] |
ZUROFF T R, CURTIS W R. Developing symbiotic consortia for lignocellulosic biofuel production[J]. Appl Microbiol Biotechnol, 2012, 93: 1423-1435. DOI:10.1007/s00253-011-3762-9 |
| [9] |
ZHANG H, PEREIRA B, LI Z, et al. Engineering escherichia coli coculture systems for the production of biochemical products[J]. Proceedings of the National Academy of Sciences, 2015, 112(27): 8266-8271. DOI:10.1073/pnas.1506781112 |
| [10] |
ZHANG T, BAO M D, YU W, et al. Genome sequence of bacillus cereus strain A1, an efficient starch-utilizing producer of hydrogen[J]. Genome Announcements, 2014, 2(3): e00494. |
| [11] |
SU H J, ZHANG T, BAO M D, et al. Genome sequence of a promising hydrogen-producing facultative anaerobic bacterium, brevundimonas naejang-sanensis strain B1[J]. Genome Announcements, 2014, 2(3): e00542. |
| [12] |
BAO M D, SU H J, TAN T W. Biohydrogen production by dark fermentation of starch using mixed bacterial cultures of bacillus sp and brevumdimonas sp[J]. Energy & Fuels, 2012, 26(9): 5872-5878. |
| [13] |
MÄKINEN A E, NISSILÄ M E, PUHAKKA J A. Dark fermentative hydrogen production from xylose by a hot spring enrichment culture[J]. International Journal of Hydrogen Energy, 2012, 37(17): 12234-12240. DOI:10.1016/j.ijhydene.2012.05.158 |
| [14] |
JAMALI N S, JAHIM J M, WAN N R W I. Biofilm formation on granular activated carbon in xylose and glucose mixture for thermophilic biohydrogen production[J]. International Journal of Hydrogen Energy, 2016, 41(46): 21617-21627. DOI:10.1016/j.ijhydene.2016.05.092 |







