氢能无污染、单位体积燃烧产生热量高,是解决传统能源污染严重和不可再生等问题的最佳替代能源[1-3]。国际氢能组织(IEA)预测,到21世纪中期,世界将全面进入氢能时代[4]。自从Fujishima和Honda[5]首次发现利用光电会使二氧化钛(TiO2)电极上产生H2,光催化分解水析氢反应(hydrogen evolution reaction, HER)开始受到研究者们的广泛关注,并对该反应进行了大量研究。
在众多的环保型光催化剂中,TiO2由于具有无毒、无污染、稳定、物质兼容性良好等优点,被认为是当前最理想的半导体光催化分解HER材料[6]。TiO2具有金红石、锐钛矿和板钛矿3种晶型,其中锐钛矿型TiO2具有良好的电子迁移效率和低的介电常数[7],是最常用的TiO2材料。但锐钛矿型TiO2能隙比较大(带隙值为3.23 eV),只有在紫外光的激发下才能表现出较弱的光催化活性,仅靠在单一的TiO2上实现HER催化效率低,成本昂贵,难以达到大规模制氢的水准[8]。因此探究提高TiO2性能的方法是HER研究领域一个亟待解决的问题。近年来,学者们通过对TiO2进行改性来提高其催化性能。目前对TiO2的改性方法主要有离子掺杂、物质吸附、半导体复合等[9],但是改性效果均很难达到工业化的要求。如Iwashina等[10]利用还原性氧化石墨烯(RGO)作为电子的传输介质,在RGO表面分别加入Pt/CuGaS2和TiO2组成“Z-Scheme”体系,可以促进HER向正向进行,但是在生产过程中会生成硫化物从而带来环境污染,同时使用的贵金属铂(Pt)价格昂贵,使得体系实现工业制氢的成本太高。
本文尝试利用Co单原子来改变TiO2的光催化性质,运用基于密度泛函理论(density functional theory, DFT)的Vienna ab-initio simulation package(VASP)软件包分别研究了Co掺杂在TiO2中和Co吸附在TiO2上的可行性。所使用的金属Co是廉价且无毒的铁磁性金属,因此合成系统中发生的反应是一种无毒、廉价、无污染的光催化分解水制氢过程,以期对工业化制氢的实现产生良好的指导作用。
1 模拟部分 1.1 计算方法和参数利用密度泛函理论的VASP软件包[11-12]进行模拟计算,基组采用投影缀加平面波(projector-augmented wave, PAW)方法[13],截断能选用500 eV。采用基于广义梯度近似(generalized gradient approximation, GGA)中的泛函revised Perdew-Burke-Ernzerhof functional(RPBE)[14]。在布里渊区选取K时采用Monkhorst-Pack方法[15];对于体材料和表面材料,分别使用11×11×11和3×3×1的网格。由于(101)表面是锐钛矿TiO2的热力学稳定面[16-17], 所以选用2×2的超胞来模拟单原子Co修饰的TiO2(101)面,电子自洽迭代和离子弛豫的收敛标准分别设为能量收敛至10-5 eV和原子力收敛至0.01 eV/ Å。所有的计算均考虑自旋极化效应。
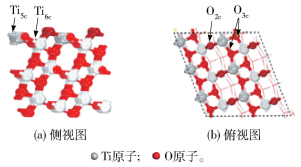
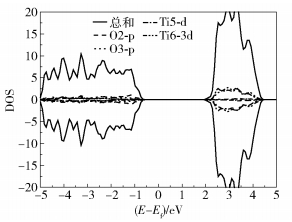
本文采用的锐钛矿型TiO2晶格参数取为实验值,a=b=3.78 Å,c=9.50 Å[18]。采用DFT+U方法[19],分别测试U=3~8 eV的情况。其中当U=6 eV时,弛豫得到TiO2晶体的禁带宽度为3.17 eV,此时禁带宽度接近实验值3.23 eV。然后选择TiO2(101)面弛豫3层结构中的上面两层,表面材料真空层设定为15 Å,得到TiO2(101)面的能量Eslab=-506.941 eV,TiO2(101)的正格矢晶胞如图 1所示。图 2为TiO2(101)表面的态密度(density of state, DOS),横坐标(E-Ef)表示相对于费米能级的能量。从图 2可以看出,TiO2(101)表面的带隙值为2.8 eV。
|
图 1 TiO2(101)表面原子位点示意图 Fig.1 Diagrammatic sketch of the atoms on a TiO2(101) surface |
|
图 2 TiO2(101)表面DOS图 Fig.2 DOS plot for a TiO2(101) surface |
根据TiO2(101)表面所具有的结构对称性可知,在TiO2(101)表面掺杂单原子Co的位点只存在两种情况,即替换表面五配位Ti5c(记为Ti5c-rp)和替换表面六配位Ti6c(记为Ti6c-rp)(图 3),根据公式
| $ \Delta E = {E_{{\rm{total}}}}-{E_{{\rm{slab}}}}-1/2{E_{{\rm{Cobulk}}}} + 1/2{E_{{\rm{Tibulk}}}} $ | (1) |

|
图 3 TiO2(101)表面Co掺杂示意图 Fig.3 Diagrammatic sketch of a Co atom doped on a TiO2(101) surface |
分别计算两种掺杂位点Ti5c-rp和Ti6c-rp的能量,如表 1所示。式(1)中Etotal表示整个体系的总能量,Eslab表示TiO2(101)表面的能量,ECobulk为Co晶胞的能量(-13.676 eV),ETibulk为Ti晶胞的能量(-8.942 eV)。
| 下载CSV 表 1 Co单原子掺杂TiO2(101)面上的形成能 Table 1 Formation energy of a Co single atom doped on a TiO2(101) surface |
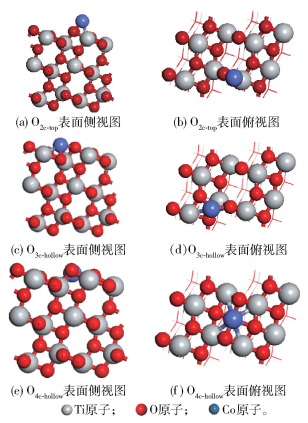
根据表面结构对称性,在TiO2(101)表面吸附Co单原子存在3个吸附活性位点,分别是二配位O(O2c)的正上方顶位(O2c-top)、O2c与两个三配位O(O3c)构成三角形的中心洞位(O3c-hollow)、两个O2c以及O3c构成四边形的中心洞位(O4c-hollow)(图 4)。根据公式
| $ \Delta E = {E_{{\rm{total}}}}-{E_{{\rm{slab}}}}-{E_{{\rm{Coatom}}}} $ | (2) |
|
图 4 TiO2(101)表面Co吸附示意图 Fig.4 Diagrammatic sketch of the Co atom adsorbed on a TiO2(101) surface |
分别计算3种吸附位点的能量,结果列于表 2,式(2)中ECoatom=-2.145 eV。
| 下载CSV 表 2 Co单原子吸附在TiO2(101)面上的形成能 Table 2 Formation energy of a Co single atom adsorbed on a TiO2(101) surface |
采用VASP软件包模拟Co原子掺杂在Ti5c位点的情况中,首先表面上每一个O2c均得到1个H原子(即半封氢,表面的每一个O2c均与1个H结合),其次表面上每一个O3c得到1个H原子(即全封氢,表面的每一个O都获得1个H),然后表面每一个O2c再得到1个H原子,从而反应生成水,此时表面Ti5c、Ti6c和Co原子裸露出来,反应结束。此过程中并没有H2产生,说明在VASP软件包模拟环境下,Co原子掺杂在Ti5c-rp位点并不能发生光催化分解水析氢反应。
通过VASP软件包模拟Co原子掺杂在Ti6c位点的情况,可以类似得到Co原子掺杂在Ti6c位点并不能发生HER。并且通过式(1)计算得到,将Co原子掺杂到Ti5c-rp和Ti6c-rp位点所需要的能量分别为4.945 eV和5.687 eV,说明掺杂所需能量过高,这也表示在实际实验中,Co原子很难通过掺杂方式进入TiO2(101)表面,因此Co掺杂模型并不能进行HER。
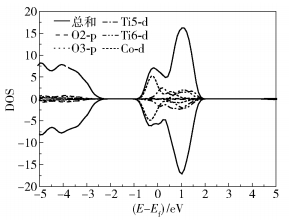
2.2 吸附模型的可行性 2.2.1 模型的确定及计算根据1.2.2节分析得知,Co原子在TiO2(101)表面吸附的构型有3种,分别为O2c-top、O3c-hollow和O4c-hollow,其中O4c-hollow是能量最低吸附位,遵循能量最低原理,可以得知自然条件下Co单原子存在的吸附位置是O4c-hollow。因此本节仅模拟了Co原子吸附在TiO2(101)表面O4c-hollow位(记为Co/TiO2(101))的加氢反应情况。在VASP软件环境下,模拟完成此过程后,首先进行Bader电荷分析,经计算Co原子从9个电子变为8.051 9个电子,说明Co在TiO2(101)表面吸附时失去了0.948 1个电子,从而TiO2(101)表面出现了电荷转移,导致费米能级向上移动(正值方向高能量区域),单原子的掺杂能级出现在原来禁带的中间且电子态的自旋劈裂明显(Co是铁磁性),禁带减小会使电子更容易在TiO2(101)表面传导,从而使TiO2(101)的DOS图(图 2)变化为Co/TiO2(101)情况下的DOS图(图 5)。
|
图 5 Co/TiO2(101)表面DOS图 Fig.5 DOS of the Co/TiO2(101) surface |
当Co/TiO2(101)结构进行加氢反应时,H原子仅可能出现在5种不同位点上,如图 6中标号1~5所示。其中,编号1为Co上方,编号2为Co最邻近O2c上方,编号3为距Co最远O2c上方,编号4为Co最邻近O3c上方,编号5为距Co最远O3c上方。
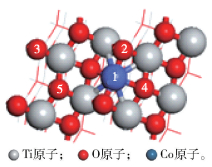
|
图 6 TiO2(101)表面H结合位点示意图 Fig.6 Diagrammatic sketch of the H atom adsorbed on TiO2(101) surface |
通过式(2)计算可得,表面的O2c与H原子的吸附能同2号(图 6中,下同)和3号的O2c与H原子的吸附能大致相同,分别为-4.490 eV,-4.435 eV;表面O3c与H原子的吸附能同4号和5号的O3c与H原子的吸附能大致相同,分别为-1.847 eV,-1.839 eV;1号的Co原子与H原子的吸附能为-1.460 eV。根据能量最低原理,表面上每一个O2c均优先得到1个H原子,称该现象为表面半封氢。当完成表面半封氢后,H的1s轨道与2号和3号O2c的2p轨道发生耦合,削弱了2号和3号O2c对Co原子的作用,从而降低1号Co原子与H原子的吸附能,经计算,该吸附能为-3.559 eV;在半封氢的条件下,2号O2c与第二个H原子的吸附能为-2.912 eV,5号O3c与H原子的吸附能也会降低(-3.899 eV),根据能量最低原理,说明当完成表面半封氢后,表面的每一个O3c会优先得到1个H原子,此现象称为表面全封氢,即完成表面羟基化反应。
当完成表面全封氢后,在VASP软件环境下首先进行Bader电荷分析。经计算Co原子从8.051 9个电子变为8.331 1个电子,这是由于表面的H原子的介入和表面的O与H原子作用,使得表面O2c与Co之间的作用减小,Co原子能与H结合从而进行HER。根据计算所得数据得到图 7,说明H的1s轨道与表面所有的O的2p轨道发生了耦合,O3c虽然与H结合,但是基本不影响Co原子对H的吸附能。经计算此时1号Co对H原子的吸附能变为-3.381 eV,而在完成全封氢后,2号O2c与第二个H原子的吸附能为-2.677 eV,5号O3c与第二个H原子的吸附能为-2.191 eV,说明当完成表面全封氢后Co会获得1个H原子。
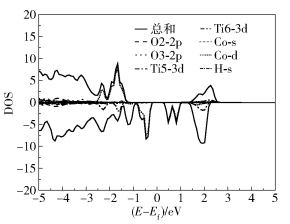
|
图 7 TiO2(101)表面全封氢DOS图 Fig.7 DOS plot for H atoms adsorbed on all the O atoms in TiO2(101) surface |
对于HER,有学者提出的“火山峰”理论较为准确地给出了各种金属表面以及合金的析氢性能判据[19-20]。ΔGH*是H原子在金属表面的吉布斯自由能[20],由式(3)、(4)确定
| $ \Delta E = {E_{{\rm{total}}}}-{E_{{\rm{slab}}}}-1/2{E_{{{\rm{H}}_{\rm{2}}}}} $ | (3) |
| $ \Delta {G_{{\rm{H*}}}} = \Delta E + 0.24{\rm{eV}} $ | (4) |
式中,Etotal、Eslab、EH2分别代表H在金属吸附时的总能量、金属层板的能量以及H2的能量,其中0.24 eV是H2吸附在基底上时的零点振动能(zero-point vibration energy, ZPVE)[21]。不同势函数计算出来的H2的ZPVE会有一些差别,范围在0.24 ~ 0.31 eV之间[21],Nørskov等[19]利用RPBE计算出H2的零点振动能为0.24 eV。对于金属表面来说,越靠近0 eV交流电流密度越大,析氢效果越好。经VASP软件包模拟计算得Etotal=-547.715 eV,Eslab=-544.181 eV,EH2=-7.046 eV。根据公式(3)、(4)计算得到吸附能ΔE=-0.011 eV,吉布斯自由能ΔGH*=0.239 eV,而Co(111)面的吉布斯自由能为0.27 eV[20]。如图 8的自由能曲线所示,Co/TiO2(101)比Co(111)的ΔGH*更趋近于0,说明Co/TiO2(101)上的HER反应速率要比纯Co(111)面高。
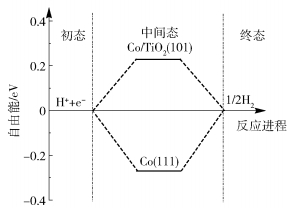
|
图 8 自由能曲线图 Fig.8 The Gibbs free energy curve |
(1) 计算结果表明,当掺杂在Ti5c-rp位点、Ti6c-rp位点时所需能量过高,导致Co原子很难通过掺杂方式进入TiO2(101)表面,且在掺杂情况下,H原子并不能与表面Co结合,因此Co掺杂模型不能进行析氢反应。
(2) Co单原子吸附在锐钛矿TiO2(101)表面会改变TiO2(101)表面的能带结构,在TiO2(101)表面的禁带中成功引入一些杂质能级,使得半导体材料能对较长波长的光子产生响应,拓宽半导体材料对光的利用区域,从而改善TiO2的光吸收性能,并加速其光催化分解水制氢反应的速率。Co原子吸附TiO2(101)整体的HER反应活性明显高于TiO2(101)以及Co(111), 形成的体系具有良好的光学稳定性。Co/TiO2(101)原料来源便宜且反应过程无污染,具有良好的发展前景。
| [1] |
DRESSELHAUS M S, THOMAS I L. Alternative energy technologies[J]. Nature, 2001, 414(6861): 332-337. DOI:10.1038/35104599 |
| [2] |
TUMER J A. Sustainable hydrogen production[J]. Science, 2004, 305(5686): 972-974. DOI:10.1126/science.1103197 |
| [3] |
GRAY H B. Powering the planet with solar fuel[J]. Nature Chemistry, 2009, 1: 7. DOI:10.1038/nchem.141 |
| [4] |
HART D. Hydrogen-a truly sustainable transport fuel?[J]. Frontiers in Ecology and the Environment, 2003, 1(3): 138-145. |
| [5] |
FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37-38. DOI:10.1038/238037a0 |
| [6] |
CARP O, HUISMAN C L, RELLER A. Photoinduced reactivity of titanium dioxide[J]. Progress in Solid State Chemistry, 2004, 32(1): 33-177. |
| [7] |
KRESSE G, FURTHMVLLER J. Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set[J]. Computational Materials Science, 1996, 6(1): 15-50. DOI:10.1016/0927-0256(96)00008-0 |
| [8] |
ZHANG X Y, SUN Y J, CUI X L, et al. A green and facile synthesis of TiO2/graphene nanocomposites and their photocatalytic activity for hydrogen evolution[J]. International Journal of Hydrogen Energy, 2012, 37(1): 811-815. DOI:10.1016/j.ijhydene.2011.04.053 |
| [9] |
XING J, JIANG H B, CHEN J F, et al. Active sites on hydrogen evolution photocatalyst[J]. Journal of Materials Chemistry A, 2013, 1: 15258-15264. DOI:10.1039/c3ta13167j |
| [10] |
IWASHINA K, IWASE A, NG Y H, et al. Z-schematic water splitting into H2 and O2 using metal sulfide as a hydrogen-evloving photocatalyst and reduced graphene oxide as a solid-state electron mediator[J]. Journal of the American Chemical Society, 2015, 137(2): 604-607. DOI:10.1021/ja511615s |
| [11] |
BLÖCHL P E. Projector augmented-wave method[J]. Physical Review B Condens Matter, 1994, 50(24): 17953-17979. DOI:10.1103/PhysRevB.50.17953 |
| [12] |
HAMMER B, HANSEN L B, NØRSKOV J K. Improved adsorption energetics within density-functional theory using revised Perdew-Burke-Ernzerhof functionals[J]. Physical Review B, 1999, 59(11): 7413-7421. DOI:10.1103/PhysRevB.59.7413 |
| [13] |
MONKHORST H J, PACK J D. Special points for Brillouin-zone integrations[J]. Physical Review B, 1976, 13(12): 5188-5192. DOI:10.1103/PhysRevB.13.5188 |
| [14] |
HORN M, SCHWERDTFEGER C F, MEAGHER E P. Refinement of the structure of anatase at several temperatures[J]. Zeitschrift für Kristallographie-Crystalline Materials, 1972, 136(3/4): 273-281. |
| [15] |
DUDAREV S L, BOTTON G A, SAVRASOV S Y, et al. Electron-energy-loss spectra and the structural stability of nickel oxide:an LSDA+U study[J]. Physical Rview B, 1998, 57(3): 1505-1509. DOI:10.1103/PhysRevB.57.1505 |
| [16] |
FAHMI A, MINOT C. A theoretical investigation of water adsorption on titanium dioxide surfaces[J]. Surface Science, 1994, 304: 343-359. DOI:10.1016/0039-6028(94)91345-5 |
| [17] |
LAZZERI M, VITTADINI A, SELLONI A. Structure and energetics of stoichiometric TiO2 anatase surfaces[J]. Physical Review B, 2001, 63: 155409. DOI:10.1103/PhysRevB.63.155409 |
| [18] |
SAQLAIN M A, ANTUNES F P N, HUSSAIN A, et al. Adsorption of oxygen and CO oxidation on Au/anatase(001) catalysts. A DFT+U study[J]. New Journal of Chemistry, 2017, 41: 2073-2080. DOI:10.1039/C6NJ02744J |
| [19] |
NØRSKOV J K, BLIGAARD T, LOGADOTTIR A, et al. Trends in the exchange current for hydrogen evolution[J]. Journal of the Electrochemical Society, 2005, 152(3): 23-26. DOI:10.1149/1.1856988 |
| [20] |
HENKELMAN G, ARNALDSSON A, JÓNSSON H. Theoretical calculations of CH4 and H2 associative desorption from Ni(111):could subsurface hydrogen play an important role?[J]. The Journal of Chemical Physics, 2006, 124: 044706. DOI:10.1063/1.2161193 |
| [21] |
HⅡNNEMANN B, MOSES P G, BONDE J, et al. Biomimetic hydrogen evolution:MoS2 nanoparticles as catalyst for hydrogen evolution[J]. Journal of the American Chemical Society, 2005, 127(15): 5308-5309. DOI:10.1021/ja0504690 |








