2. 中国科学院过程工程研究所, 中国科学院绿色过程与工程重点实验室, 湿法冶金清洁生产技术国家工程实验室, 北京 100190;
3. 中国科学院大学 化学与化工学院, 北京 100080
2. Key Laboratory of Green Process and Engineering, National Engineering Laboratory for Hydrometallurgical Cleaner Production Technology, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190;
3. School of Chemistry and Chemistry Engineering, University of Chinese Academy of Sciences, Beijing 100080, China
异氰酸酯是合成高端聚氨酯的重要中间体,其中1, 6-己二异氰酸酯(HDI)是目前应用最为广泛的一种脂肪族异氰酸酯[1]。相比于芳香族的二苯甲烷二异氰酸酯(MDI)、苯异氰酸酯(TDI)等,HDI的饱和直链烷烃结构使得其聚氨酯衍生物具有色泽鲜艳、硬度适中、不泛黄、抗粉化、耐户外曝晒等优点[2]。因此,HDI广泛应用在汽车飞机OEM涂料、高档木制家具漆、防腐蚀涂料及光稳定性好的粘结剂等方面[3-5]。目前HDI主要采用光气法合成[6],此技术路线存在污染环境、副产物盐酸腐蚀设备等缺点[7],因此开展非光气法合成HDI的研究至关重要。
在各种非光气合成HDI路线中,以液相溶剂为热载体的己二氨基甲酸甲酯(HDC)热解制备HDI反应条件温和、副产物可循环利用[8-9],具有广阔的工业化发展前景[10]。在目前所报道的热解溶剂中[11],癸二酸二辛酯(DOS)具有良好的热稳定性和化学稳定性,是理想的HDC热解制备HDI的溶剂热载体[12],在该溶剂体系下,HDI的收率最高可达到66.51%[13]。以本课题组新开发的分子筛为催化剂,在癸二酸二辛酯体系中热解HDC,HDI的收率可达到83.8%[14]。因此癸二酸二辛酯是非常有应用潜力的HDC热解溶剂。HDC热解反应结束后,为获得高纯度的HDI产品并实现溶剂循环回收利用,需进行HDI与溶剂二元体系的分离。二元体系分离过程的设计和优化需要相应的热力学数据,但迄今为止,针对HDI及其混合物相关气液相平衡数据测定的研究开展极少。徐勉等[15]采用自制的气液平衡釜测定了HDI与苯甲酸乙酯、丁二酸二乙酯、己二酸二甲酯的气液相平衡数据,但仅研究了0.55 kPa压力下二元组份的气液相平衡。且现有文献中并没有关于HDI和DOS二元体系的气液相平衡数据的报道。
因此,本文采用准静态的方法测定了368.75~423.00 K温度范围内HDI单组份的饱和蒸汽压,以及HDI与癸二酸二辛酯在369.81~424.55 K温度范围内的气液相平衡数据,并使用Aspen Plus软件对实验数据进行了回归,关联得到了Wilson及溶液理论中非随即(局部)双液体(NRTL)模型参数,为HDI的精制分离提供基础物性数据。
1 实验部分 1.1 实验原料及仪器 1.1.1 实验原料1, 6-己二异氰酸酯(HDI),工业级,烟台万华有限公司;癸二酸二辛酯(DOS),分析纯,国药集团有限公司。
1.1.2 实验仪器斜式沸点仪(CP-Ⅱ),杭州市浙化玻璃经营部;高真空油泵(RV-3),英国爱德华公司;真空压力计(KJLC354),美国科莱斯特公司;单回路显示温控仪(HB-C703-01-23-HL-P),香港汇邦科技有限公司;电子天平(AL104-IC),梅特勒-托利多仪器(上海)有限公司。
1.2 实验装置在采用传统的沸点仪测定沸点时,体系达到稳定状态的同时需要液体达到足够的气化量[16-17],在此状态下,系统难以达到准静态。为达到准静态的操作方式,本文对传统的沸点仪进行了两方面的改造:(1) 将直式沸点仪改为斜式沸点仪,以降低液体提升高度;(2) 通过增大机械驱动力的方式降低加热功率[18]。改造后的沸点仪如图 1所示。实验温度由温控仪测定,精度为0.1 K,系统真空度由真空压力计测定,精度为0.1 Pa。装置可靠性检验与前期工作使用的方法一致[19]。
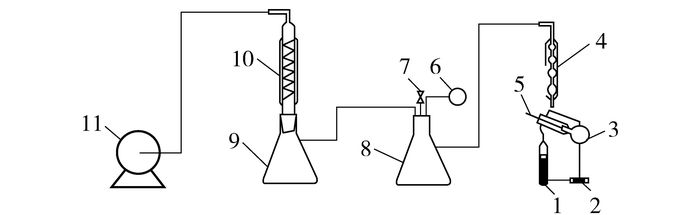
|
1—电加热棒;2—磁力转子;3—斜式沸点仪;4—一级冷凝;5—精密温度计;6—真空压力计;7—针阀;8—缓冲瓶1#;9—缓冲瓶2#;10—二级冷凝;11—真空泵。 图 1 实验装置图 Fig.1 The all-glass inclined ebulliometer |
样品的气液相平衡测定方法如下:准确称量85 g的样品,精度为0.0001 g,通过CP-Ⅱ斜式沸点仪的冷凝管接口注入沸点仪中。打开真空泵调节压力至指定压力,利用加热棒加热样品,缓慢升温直至液体过热,蒸汽与液体混合物喷向温度计套管,当温度计读数保持稳定达到30 min时,记录此时的压力及温度。调节压力,记录多组温度压力数据。HDI在高温下易发生自聚反应,因此,物料在高温下回流时间不宜过长,每4 h需采用一组新料。
2 热力学模型 2.1 气液平衡基本方程当气液两相达到平衡时,有气液平衡计算通式
| $\varphi _i^{\rm{V}}p{y_i} = {\gamma _i}p_i^{\rm{S}}\varphi _i^{\rm{S}}{\rm{exp}}\int_{p_i^{\rm{S}}}^p {\frac{{V_i^{\rm{L}}}}{{RT}}} {\rm{d}}p$ | (1) |
其中,T、p分别为体系的温度、压力,yi为气相中组分i的摩尔分数,φiV为气相混合物中组分i在体系温度为T、压力为p时的逸度系数,piS为纯组分i在体系温度T时的饱和蒸汽压, φiS为纯组分i在体系温度与其饱和蒸汽压piS下的逸度系数,ViL为纯组分i在体系温度T时的液相摩尔体积,γi为组分i的活度系数,
低压下,可将HDI与癸二酸二辛酯二元体系的气相视为理想气体,
| $p{y_i} = p_i^{\rm{S}}{x_i}{\gamma _i}$ | (2) |
其中,p为系统压力,yi、xi分别为气相、液相摩尔分数,γi为液相中组分i的活度系数,piS为纯组分i的饱和蒸汽压[21]。
2.2 Wilson模型Wilson模型引入了局部组成的概念,在由分子i与分子j组成的溶液中,由于i-i与i-j之间的相互作用不同,在分子i周围出现分子i和分子j的概率不仅取决于其组成xi和xj,还与相互作用的强弱有关。
| ${\rm{ln}}{\gamma _i} = 1 - {\rm{ln}}\left( {\sum\limits_{j = 1}^N {{x_j}{\mathit{\Lambda }_{ij}}} } \right) - {\rm{ }}\sum\limits_{k = 1}^N {\left( {\frac{{{x_k}{\mathit{\Lambda }_{ki}}}}{{\sum\limits_{j = 1}^N {{x_j}{\mathit{\Lambda }_{kj}}} }}} \right)} $ | (3) |
其中
| ${\mathit{\Lambda }_{ij}} = \frac{{V_j^{\rm{L}}}}{{V_i^{\rm{L}}}}{\rm{exp}}\left[ {\frac{{ - ({\lambda _{ij}} - {\lambda _{ii}})}}{{RT}}} \right]$ | (4) |
ViL、VjL为系统温度下的纯液体摩尔体积,(λ12-λ11)、(λ21-λ22)为能量参数。
2.3 溶液理论中非随即(局部)双液体(NRTL)模型方程NTRL方程[21]是对Wilson方程进行修正,并在双流体理论的基础上提出的,如式(5) 所示
| $\begin{array}{l} {\rm{ln}}{\gamma _i} = \frac{{\sum\limits_{j = 1}^N {{x_j}{\tau _{ji}}{G_{ji}}} }}{{\sum\limits_{k = 1}^N {{x_k}{G_{kj}}} }} + \sum\limits_{j = 1}^N {\frac{{{x_j}{G_{ji}}}}{{\sum\limits_{k = 1}^N {{x_k}{G_{kj}}} }}} \\ \left( {{\tau _{kj}} - \frac{{\sum\limits_{k = 1}^N {{x_j}{\tau _{kj}}{G_{kj}}} }}{{\sum\limits_{k = 1}^N {{x_k}{G_{kj}}} }}} \right) \end{array}$ | (5) |
其中,模型参数τij和Gij分别表示为
| ${\tau _{ij}} = \frac{{{g_{ij}} - {g_{ii}}}}{{RT}}$ | (6) |
| ${G_{ij}} = {\rm{exp}}( - {\alpha _{ij}}{\tau _{ij}})$ | (7) |
式中,gij-gii是能量参数,αij为非无规参数,且有αij=αji=α。对于非极性体系,NRTL模型的非随机性因子αij=0.3。
2.4 相对挥发度相对挥发度定义如式(8) 所示
| $\alpha = \frac{{{y_i}/{x_i}}}{{{y_j}/{x_j}}}$ | (8) |
其中,y和x分别为相应组份气、液相的摩尔分数。
3 结果与讨论 3.1 HDI饱和蒸汽压由式(2) 可知,气液相达到平衡时气相组成的计算需用到纯组分i的饱和蒸汽压piS。因此,本文测定了纯组分HDI在368.75~423.00 K的饱和蒸汽压,具体数据如表 1所示。利用Aspen Plus软件拟合得到了Antoine方程参数,A=62.12,B=-7258.20,C=-7.30。图 2为Antoine方程对HDI饱和蒸汽压数据的拟合结果。经计算可得,实验测得的HDI的饱和蒸汽压与拟合值的平均绝对偏差为0.298%,据此认为得到的Antoine方程参数可信。
| 下载CSV 表 1 HDI饱和蒸汽压数据 Table 1 The vapor pressure data of HDI |
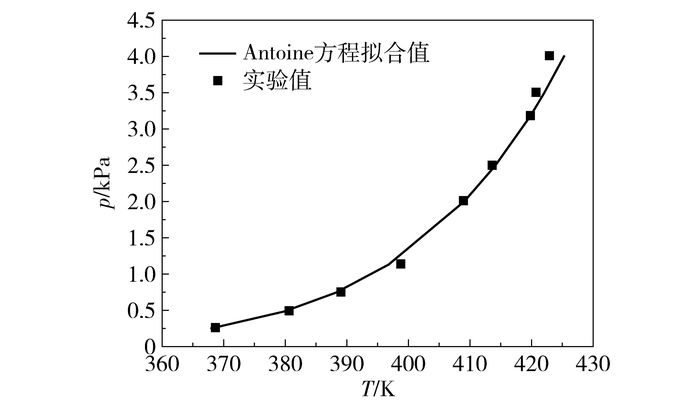
|
图 2 HDI饱和蒸汽压曲线 Fig.2 Vapor pressures of HDI |
在拟合得到HDI的Antoine方程的基础上,测定了HDI与癸二酸二辛酯在0.300、0.400、0.500、0.700、0.900 kPa压力下二元体系气液相平衡数据。实验温度低于424.55 K,以防止HDI聚合。HDI的摩尔分数分别为0.350、0.500、0.650、0.750、0.857、0.950。准静态方法认为HDI的液相组成xi与进料组成zi近似相等,气相组成可由液相计算得出。得到HDI的Antoine方程
| ${\rm{ln}}p_i^{\rm{S}} = 62.12 - \frac{{ - 7258.20}}{{ - 7.30 + T}}$ |
实验所得数据经Aspen Plus拟合,实验值与拟合值如表 2所示,图 3为二元组分的T-p-x数据。可以看到,在0.300~0.900 kPa压力范围内,NRTL模型和Wilson模型拟合结果与实验结果吻合程度较高,温度平均绝对偏差分别为1.56 K和1.55 K。在0.300 kPa压力下温度平均绝对偏差最小,这是由于温度较低时HDI比较稳定。在所测量的压力范围内,平均绝对偏差随压力的增大而减小,这是由于在高真空的压力下,实验操作更难达到稳定状态。
| 下载CSV 表 2 不同压力下HDI-癸二酸二辛酯二元气液相平衡数据 Table 2 VLE data for the HDI and DOS system at different pressures |
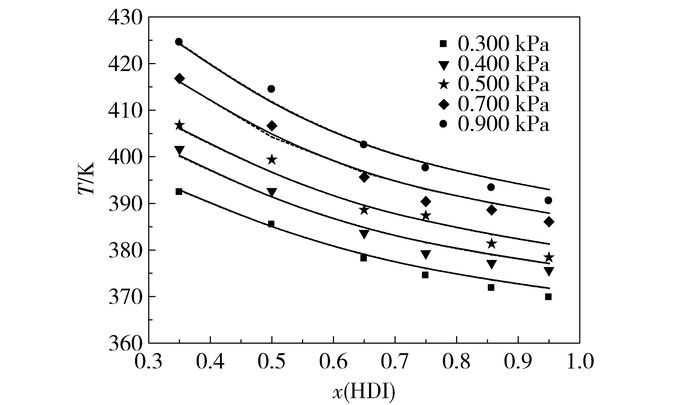
|
图 3 HDI与癸二酸二辛酯二元体系气液平衡数据 Fig.3 VLE phase diagram of the HDI and DOS binary system |
实验值与NRTL模型、Wilson模型拟合值的绝对偏差结果如表 3所示。可以看到,NRTL模型的温度平均绝对偏差为1.56 K,而Wilson模型的温度平均绝对偏差为1.55 K。NRTL模型与Wilson模型的压力平均绝对偏差和组成平均绝对偏差分别为0.002、0.001。因此,NRTL模型和Wilson模型均可以对0.300~0.900 kPa下测量的气液相平衡数据进行准确地回归。
| 下载CSV 表 3 实验值与NRTL及Wilson模型拟合值间绝对偏差 Table 3 Absolute deviations between experimental and regressed data with NRTL and Wilson models |
为考察将HDI产品从HDI/癸二酸二辛酯二元体系中分离的难易程度,在Wilson模型拟合值的基础上研究了0.300~0.900 kPa压力范围内HDI/癸二酸二辛酯的相对挥发度。相对挥发度α与HDI物质的量分数x(HDI)之间的关系如图 4所示。由图 4可知,当HDI摩尔分数大于0.9时,相对挥发度随HDI摩尔分数的减少而增大;当HDI的摩尔分数小于0.9时,相对挥发度随HDI的摩尔分数减小而减小,但相对挥发度远远大于1;HDI的摩尔分数继续降低至0.1时,相对挥发度小于1。因此,当HDI摩尔分数小于0.1时,不能通过精馏的方式将两者分离,当HDI摩尔分数大于0.1时,可以通过精馏的方式将两者分离。且HDI的浓度越高,绝对压力越高,相对挥发度越大,即HDI分离难度越小。
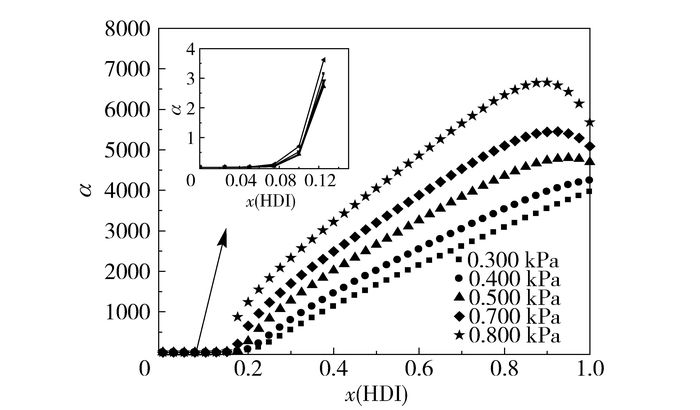
|
图 4 不同压力下HDI与癸二酸二辛酯的相对挥发度 Fig.4 Relative volatility (α) of HDI and DOS at different pressures |
在共沸物达到其共沸点时,由于沸腾所产生的气体组成与液体完全相同,因此无法以蒸馏方法将溶液成分进行分离。为考察能否通过蒸馏的方式分离HDI,在Wilson模型拟合值的基础上研究了在0.300 kPa~0.900 kPa的压力范围内HDI与癸二酸二辛酯的T-x-y关系。各压力下T-x-y关系如图 5所示。由图 5可知,HDI与癸二酸二辛酯在各压力下均能形成最高共沸物。共沸物的组成与共沸温度如表 4所示。由表 4可知,随着压力的增大,HDI/癸二酸二辛酯体系共沸温度逐渐升高,共沸物中HDI的摩尔分数也逐渐增大。
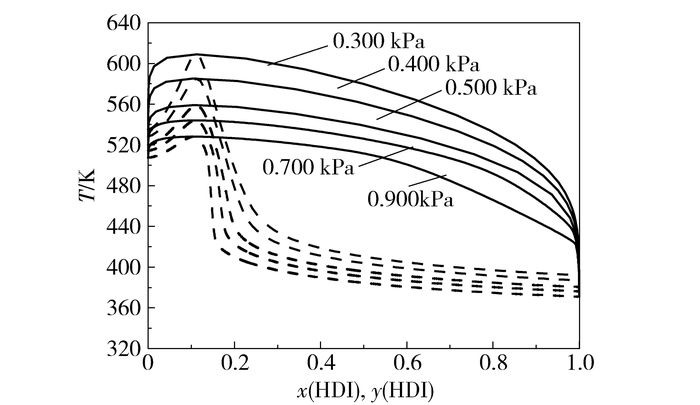
|
图 5 不同压力下T-x-y图 Fig.5 T-x-y diagram of the HDI/DOS system at different pressures |
| 下载CSV 表 4 不同压力下HDI与癸二酸二辛酯的共沸组成与共沸温度 Table 4 Azeotropic composition and azeotropic temperature of the binary systems |
(1) HDI的Antoine参数为:A=62.1,B=-7258.20,C=-7.30。可由此预测不同温度下HDI的饱和蒸汽压。
(2) 采用NRTL和Wilson模型方法对HDI/DOS二元组分气液相平衡数据进行了拟合,拟合结果良好,温度平均绝对偏差均小于1.56 K。
(3) HDI与癸二酸二辛酯在1 kPa下存在最高共沸现象,在所研究压力范围内,共沸物中HDI的摩尔分数为0.105~0.112。因此,在HDI精制分离时,循环溶剂中会携带10%左右的HDI。
| [1] |
Hyun M J, Shin M, Kim Y J, et al. Phosgene-free decomposition of dimethylhexane-1, 6-dicarbamate over ZnO[J]. Research on Chemical Intermediates, 2016, 42(1): 57-70. DOI:10.1007/s11164-015-2224-x |
| [2] |
周昱, 程杰, 刘良明, 等. 六亚甲基-1, 6-二异氰酸酯的合成工艺[J]. 聚氨酯工业, 2006, 21(4): 44-47. Zhou Y, Cheng J, Liu L M, et al. The synthesis of hexamethylene-1, 6-diisocyanate[J]. Polyurethane Industry, 2006, 21(4): 44-47. (in Chinese) |
| [3] |
吴蓁, 郭青, 崔文晔. 高铁用高强度聚氨酯防水涂料配方设计与制备工艺[J]. 新型建筑材料, 2011, 38(5): 72-75. Wu Z, Guo Q, Cui W Y. The formulation and preparation of high-strength polyurethane waterproof coating for the high speed rail[J]. New Building Materials, 2011, 38(5): 72-75. (in Chinese) |
| [4] |
徐归德, 韩宝乐, 于文杰. 聚氨酯材料在现代汽车工业上的应用[J]. 聚氨酯工业, 2006, 21(6): 1-5. Xu G D, Han B L, Yu W J. Recent status of polyureathane meterial in application of the automobile industry[J]. Polyurethane Industry, 2006, 21(6): 1-5. (in Chinese) |
| [5] |
李婷. 环保型聚氨酯胶粘剂的市场观察与分析[J]. 聚氨酯, 2015(10): 60-66. Li T. Market observation and analysis of environmental friendly polyurethane adhesive[J]. Polyurethane, 2015(10): 60-66. (in Chinese) |
| [6] |
Horvath M J, Saylik D, Elmes P S, et al. A mitsunobu-based procedure for the praperation of alkyl and hindered aryl isocyanates from primary amines and carbon dioxide under mild conditions[J]. Tetrahedron Letters, 1999, 40: 363-366. DOI:10.1016/S0040-4039(98)02312-0 |
| [7] |
马德强, 宋锦宏, 丁建生. 有机异氰酸酯的生产及市场消费状况[J]. 化工进展, 2007, 26(5): 743-749. Ma D Q, Song J H, Ding J S. Production and consumptions of organic isocyanates[J]. Chemical Industry and Engineering Progress, 2007, 26(5): 743-749. (in Chinese) |
| [8] |
申宏丹, 王记莲. 1, 6-六亚甲基二氨基甲酸甲酯液相催化分解反应研究[J]. 河北化工, 2010, 33(1): 28-32. Shen H D, Wang J L. Liquid-phase catalytic decomposition reaction of 1, 6-hexamethylene diisocyanate[J]. Hebei Chemical Industry, 2010, 33(1): 28-32. (in Chinese) |
| [9] |
覃宁波, 李会泉, 曹妍, 等. 低沸点溶剂加压催化热解制备六亚甲基-1, 6-二异氰酸酯[J]. 石油化工, 2013, 42(10): 1141-1147. Qin N B, Li H Q, Cao Y, et al. Preparation of 1, 6-hexamethylene diisocyanate by catalytic thermal decomposition with low-boiling solvent under pressure[J]. Petrochemical Technology, 2013, 42(10): 1141-1147. (in Chinese) DOI:10.3969/j.issn.1000-8144.2013.10.013 |
| [10] |
朱长春, 吕国会. 中国聚氨酯产业现状及"十三五"发展规划建议[J]. 聚氨酯工业, 2015, 30(3): 1-25. Zhu C C, Lv G H. Polyurethane industry status in China and proposal of 13th five-year plan[J]. Polyurethane Industry, 2015, 30(3): 1-25. (in Chinese) |
| [11] |
刘玉华, 田恒水, 张海群. 1, 6-六亚甲基二异氰酸酯的绿色合成[J]. 广东化工, 2011, 38(5): 91-92. Liu Y H, Tian H S, Zhang H Q. Green synthesis of hexamethylene diisocyanate[J]. Guangdong Chemical Industry, 2011, 38(5): 91-92. (in Chinese) |
| [12] |
刘益军. 聚氨酯原料及助剂手册[M]. 2版. 北京: 化学工业出版社, 2012: 439. Liu Y J. Handbook of raw materials and additives for polyurethanes[M]. 2nd ed. Beijing: Chemical Industry Press, 2012: 439. (in Chinese) |
| [13] |
吴魏, 翟涛, 田恒水. 非光气法合成六亚甲基二异氰酸酯的研究[J]. 广东化工, 2009, 36(8): 36-37. Wu W, Zhai T, Tian H S. Synthesis of hexamethylene diisocyanate by non-phosgene method[J]. Guangdong Chemical Industry, 2009, 36(8): 36-37. (in Chinese) |
| [14] |
池亚芳. 六亚甲基二氨基甲酸甲酯热解制备六亚甲基二异氰酸酯反应分离过程的应用基础研究[D]. 北京: 北京化工大学, 2017. Chi Y F. Basic study on the reaction-seperation process of thermal decomposition of dimethylhexane dicarbamate to hexamethylene diisocyanate[D]. Beijing:Beijing University of Chemical Technology, 2017.(in Chinese) |
| [15] |
徐勉, 吴良衡, 张杰. HDI/共沸剂二元体系汽液平衡数据的测定及关联[J]. 化学工程, 2016, 44(2): 28-34. Xu M, Wu L H, Zhang J. Measurement and correlation of vapor-liquid equilibrium data for HDI/entrainer[J]. Chemical Engineering(China), 2016, 44(2): 28-34. (in Chinese) |
| [16] |
Oktavian R, Amidelsi V, Rasmito A, et al. Vapor pressure measurements of ethanol-isooctane and 1-butanol-isooctane systems using a new ebulliometer[J]. Fuel, 2013, 107: 47-51. DOI:10.1016/j.fuel.2013.02.005 |
| [17] |
陈卫航, 李清亚, 蒋元力, 等. 乙二醇-1, 4-丁二醇二元物系6.67 kPa下汽液平衡研究[J]. 高校化学工程学报, 2015, 29(1): 238-241. Chen W H, Li Q Y, Jiang Y L, et al. Investigation on vapor-liquid equilibrium for binary system of ethylene glycoland 1, 4-butylene glycol under 6.67 kPa[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(1): 238-241. (in Chinese) |
| [18] |
Li Y Q, Wang L G, He P, et al. Isobaric vapor-liquid equilibrium for binary system of aniline+methyl-b-phenyl carbamate[J]. Chinese Journal of Chemical Engineering, 2016, 24(10): 1470-1476. DOI:10.1016/j.cjche.2016.05.026 |
| [19] |
Xu D H, Li H Q, Li Z B. Determination and modeling of isobaric vapor-liquid equilibria for the methylcarbamate+methyl-N-phenyl carbamate system at different pressures[J]. Journal of Chemical & Engineering Data, 2013, 58: 3110-3117. |
| [20] |
Li H R, Han S J, Teng Y. Bubble points measurement for system chloroform-ethanol-benzene by inclined ebulliometer[J]. Fluid Phase Equilibria, 1995, 113: 185-195. DOI:10.1016/0378-3812(95)02809-3 |
| [21] |
陈新志, 蔡振云, 胡望明, 等. 化工热力学[M]. 3版. 北京: 化学工业出版社, 2009: 87. Chen X Z, Cai Z Y, Hu W M, et al. Chemical engineering thermodynamics[M]. 3rd ed. Beijing: Chemical Industry Press, 2009: 87. (in Chinese) |








