心、脑血管疾病作为一种威胁人类健康的重大疾病,血小板激活和凝聚在其形成过程中有着重要作用[1]。已有的抗血小板药物或多或少都具有一定的缺点,如阿司匹林(Aspirin)抵抗、氯吡格雷(clopidogrel)和替卡格雷(Ticagrelor)出血事件等[2-4]。因此,研究疗效更好、副作用更低的抗血小板药物是目前亟待解决的一个问题。
腺苷类衍生物因与人体内三磷酸腺苷(ATP)具有相似的结构而在很多药物方面都有应用,如风湿性关节炎[5]、抗病毒[6]、抗流感[7]等领域。有文献报道[8],2-烷硫基-6-烷氨基取代的腺苷衍生物具有较高的抗血小板凝聚活性。借用计算机辅助药物设计的方法,有利于为这类腺苷衍生物提供较好的先导化合物设计途径。
自组织分子场分析(SOMFA)[9]作为一种有潜力的三维定量构效关系(3D-QSAR)方法[10],最近已经被引入并应用于药物化学[11-12]甚至食品化学[13]领域。SOMFA技术的基础理论是使用点网格来生成描述符,主要依赖于内在的分子性质描述符,如形状和静电作用。SOMFA算法的一个新颖特征是具有内置的回归方法如最小偏差二乘法(PLS),而不是依赖外部方法[14]。
本文采用SOMFA分析法,建立嘌呤核苷衍生物的分子立体场、静电场模型,分析研究结构因素对嘌呤核苷衍生物抗血小板凝集活性的贡献,为日后有目的地设计、合成高活性的抗血小板药物分子提供理论指导。
1 计算方法 1.1 化合物数据本文选择本课题组合成、已测试活性的一类新型嘌呤类衍生物[15],结构如图 1所示。相应的32个化合物的相关数据列于表 1中。将表中具有测试活性的20个化合物随机分成训练集和测试集,其中训练集16个,测试集4个。
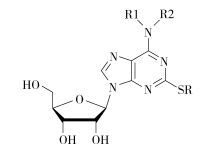
|
图 1 嘌呤衍生物的公共分子图 Fig.1 Public molecular map of purine derivatives |
| 下载CSV 表 1 嘌呤类衍生物的结构及活性 Table 1 The structure and biological activity of purine derivatives |
采用Chem 3D软件建立20个嘌呤类衍生物的分子结构,并通过MMFF4分子力学方法对分子结构进行全优化。计算时采用负对数pIC50=-lg(IC50),其中IC50为测量的嘌呤类衍生物的半抑制浓度。将所有的分子进行几何构型优化后,以共同的骨架为模板,进行基于共同结构的分子叠合,本文选择两种叠合方式,分别为骨架叠合1和药效团叠合2,分子叠合图示于图 2、3中。
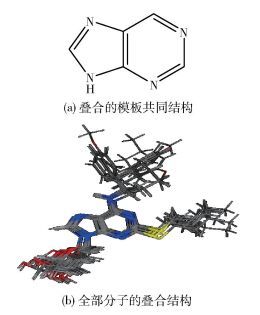
|
图 2 骨架1方式的分子结构叠合图 Fig.2 Superposition of molecules with backbone 1 |
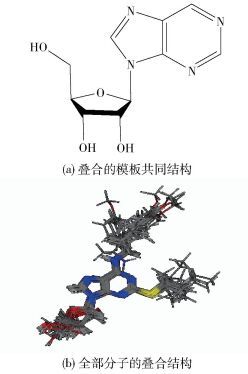
|
图 3 骨架2方式分子的结构叠合图 Fig.3 Superposition of molecules with backbone 2 |
首先,将用叠合方法处理好的分子进行加电荷处理,采用AM1、PM3以及MNDO 3种半经验方法计算电荷。其次,进行SOMFA方法研究。与本课题组前期的研究类似[16-18],使用SOMFA软件将有测试活性的20个嘌呤腺苷衍生物的分子结构和活性数据导入其中,步骤为: ① 对训练集进行计算,用软件SOMFA生成一个三维网格,其体积为4 nm×4 nm×4 nm,坐标原点为(-20, -20, -20),将叠合好的分子置于该三维网格中,设置探测步长分别为0.05 nm和0.1 nm,探讨不同探测步长对结果的影响;② 计算出静电场和立体场势能后,为衡量静电效应和立体效应对药物活性的影响大小,建立一个非线性方程
| $A = {c_1}{A_{\text{S}}} + \left( {1 - {c_1}} \right){A_{\text{E}}}$ | (1) |
其中,A为总活性,AS为立体场活性,AE为静电场活性,c1是常数,0<c1<1,采用多元线性回归的方法可以得出c1值,利用PLS计算出交叉验证系数(rcv2)与非交叉验证系数(r2);③ 分别计算在不同探测步长、不同分子叠合方式和不同电荷计算方法下的标准方差s、检验值F、r2和rcv2,可以得出12个SOMFA模型,如表 2所示。
| 下载CSV 表 2 不同叠合方式、荷载电荷以及网格精度下SOMFA模型的统计结果 Table 2 Statistical results of SOMFA models with different alignment, charges and resolution of grid |
全部计算均在Intel i7-4790 CPU/Microsoft Win 7高性能电脑上完成,所有参数若未特别指明,均使用电脑软件缺省值。
2 结果与讨论 2.1 SOMFA模型分析从表 2中可以得出,在计算得到的所有模型中,最佳模型是第11个模型。由该模型可知交叉验证系数rcv2为0.801,非交叉验证系数r2为0.807,统计方差比F=75.281,标准方差s为0.130,表明此模型的线性相关度和可信度是比较高的。本文就电荷类型、步长等因素对模型结果的影响进行了分析。
2.1.1 电荷计算方法的影响分析表 2可以得出,在3种电荷计算方法中,MNDO电荷计算方法相对来说比较符合实际分子结构,得到的rcv2和r2值比较高。但从总体上来说,不同的电荷计算方法不具有十分明显的规律性。
2.1.2 探测步长的影响分析表 2可以看出,采用不同步长计算出的rcv2与r2值符合一定的规律性。在所有模型中,对于rcv2与r2,在步长为0.05 nm下的值均大于0.1 nm下对应的值;本文只采用0.05 nm和0.1 nm两种步长计算,而没有采用0.15 nm和小于0.05 nm的步长进行计算,是因为如果步长太大时,就会造成某一个区域信息的严重丢失,计算的结果不够精确;另外,当步长小于0.05 nm时,计算速度太慢,耗费大量的时间,计算的结果可能比较精确,但如果进一步减小步长,步长太小时PLS的计算会有比较大的噪音,进而影响所得结果。
2.1.3 c1值的变化c1值越大,立体效应对分子生物药物活性贡献越大,c1值越小,静电效应对分子生物药物贡献越大。因此,立体效应与静电效应对分子生物药物贡献大小用参数c1表示。分析表 2可以看出,在12种模型中,c1值均大于0.5,表明在12种模型中立体效应对分子药物活性贡献均大于静电效应对分子生物活性贡献。其中可能的原因是当分子具有优良的空间构型时,分子的药效团能很好地与配体蛋白质匹配,产生药效作用。因此,将来在设计新型嘌呤腺苷衍生物分子时,要着重考虑分子的空间效应对分子药物活性的影响。
2.2 SOMFA模型的验证如2.1节所述,经过对20个具有测试活性的嘌呤腺苷衍生物分子进行SOMFA分析,对比得出其中最佳模型为第11个模型。采用这个最佳模型计算出各个化合物的预测活性,表 1列出了这20个化合物的预测活性值。
为了进一步对该最佳模型进行检验,采取了线性回归的分析方法,分别对训练集与测试集的预测活性和实验活性值进行线性拟合,结果如图 4所示。
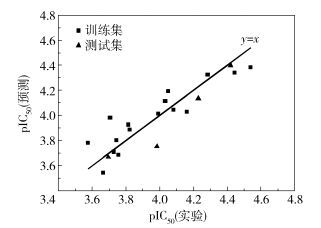
|
图 4 模型11的实验活性和预测活性线性相关图 Fig.4 The regression of predicted activities versus observed activities onto a linear relationship for model 11 |
训练集与测试集的线性相关系数分别为0.80、0.88,表明训练集的预测活性和实验活性具有良好的相关性,即该最佳模型有良好的自身一致性;测试集的预测活性与实验活性也有良好的相关性,表明该最佳模型对化合物的药物活性具有可靠的预测能力。
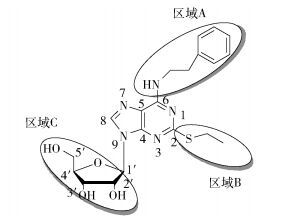
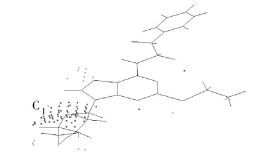
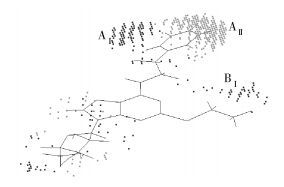
2.3 三维网格图通过计算分析可知最佳常数c1为0.626,表明其立体场对活性的贡献为62.6%,静电场对活性的贡献为37.4 %,由此看出化合物的立体效应对活性影响更大。为了更深一步地探讨两种效应对分子药物活性的影响,将活性最好的化合物19作为参照分子,对其进行区域划分,如图 5所示。通过最佳模型分别得到了立体场和静电场的三维网格图,如图 6、7所示。
|
图 5 模板化合物分子19的结构图 Fig.5 Structure of molecule 19 used as template compound |
|
图 6 SOMFA模型静电场系数等势图,参照分子为化合物19 Fig.6 The electrostatic potential master grid of the SOMFA model with compound 19 |
|
图 7 SOMFA模型立体场系数等势图,参照分子为化合物19 Fig.7 The shape master grid of the SOMFA model with compound 19 |
在图 6的静电场的三维网格图中,下标Ⅰ表示引入电负性基团对活性有利。分析图 6的静电场的三维网格图可以看出,取代基苯环(区域A)和烷硫基(区域B)对活性影响很小;但发现糖环取代基(区域CⅠ)有浓密的格点存在,表明此处存在电负性取代基是对活性有利的。
分析图 7的立体场的三维网格图,下标Ⅰ表示引入体积小的基团对活性有利,下标Ⅱ表示引入体积大的基团对活性有利。由图 7可知区域A的末端分布有浓密的格点(区域AⅡ),表明增大立体效应是有利的;区域A左侧位置还存在一连窜浓密的格点(区域AⅠ),说明在6号位(区域A)不能直接连接大取代基,可能是药物与受体作用时,区域A基团进入一个入口处口径比较小的口袋中。同时也发现2号位(区域BⅠ)有些许格点,表明此处立体效应稍小的中等大小取代基能使药物活性得到提高。
基于以上对静电场和立体场的分析,分别找到区域A、B和C每一个取代基的主要作用,这样就可以考虑在活性最高的化合物19的每一个位置选择新取代基来整合有利因素设计新化合物。总之,在区域A的6号位采用大取代基团如苯基以及杂环等,可以提高抗血小板凝聚活性。如本课题组邓聪迩[19]将6位修饰为杂环取代也能增加其抗血小板凝聚活性。在区域C糖环位置增加强的氢键给体基团如—COOH, —CH(COOH)2等能使药物活性进一步得到提高。Douglass等[20]研究了5′位修饰的腺苷衍生物,发现随着5′位氢键给体基团的增强,抗血小板凝聚活性逐渐增强,与本文结论一致。
3 结论(1) 通过多元回归方法得到了最佳的SOMFA模型的交叉验证系数rcv2=0.801,非交叉验证系数r2=0.807,统计方差比F=75.281,标准方差s=0.130。
(2) 所得的模型通过测试集得到验证,测试集的线性相关系数为0.88,表明该模型有较好的预报能力。
(3) 立体场对活性的贡献为62.6%,静电场对活性的贡献为37.4 %,表明化合物的立体效应对活性影响更大。
| [1] |
孙忠实, 朱珠, 肖燕萍. 抗血小板药物的合理应用(二)[J]. 中国药物警戒, 2007, 4(5): 297-302. Sun Z S, Zhu Z, Xiao Y P. Rational application of antiplatelet drugs[J]. Chinese Journal of Pharmacovigilance, 2007, 4(5): 297-302. (in Chinese) |
| [2] |
Papathanasiou A, Goudevenos J, Tselepis A D. Resistance to aspirin and clopidogrel:possible mechanisms, laboratory investigation, and clinical significance[J]. Hellenic Journal of Cardiology, 2007, 48(6): 352-363. |
| [3] |
Schr r K. The basic pharmacology of ticlopidine and clopidogrel[J]. Platelets, 1993, 4(5): 252-261. DOI:10.3109/09537109309013225 |
| [4] |
Husted S, van Giezen J J J. Ticagrelor:the first reversibly binding oral P2Y12 receptor antagonist[J]. Cardiovascular Therapeutics, 2009, 27(4): 259-274. DOI:10.1111/cdr.2009.27.issue-4 |
| [5] |
Borea P A, Varani K, Vincenzi F, et al. The A3 adenosine receptor:history and perspectives[J]. Pharmacological Reviews, 2015, 67(1): 74-102. |
| [6] |
McGuigan C, Serpi M, Slusarczyk M, et al. Anti-flavivirus activity of different tritylated pyrimidine and purine nucleoside analogues[J]. ChemistryOpen, 2016, 5: 227-235. DOI:10.1002/open.201500216 |
| [7] |
Meneghesso S, Vanderlinden E, Brancale A, et al. Synthesis and biological evaluation of purine 2'-fluoro-2'-deoxyriboside protides as anti-influenza virus agents[J]. ChemMedChem, 2013, 8(3): 415-425. DOI:10.1002/cmdc.v8.3 |
| [8] |
Halbfinger E, Major D T, Ritzmann M, et al. Molecular recognition of modified adenine nucleotides by the P2Y1-receptor. 1. A synthetic, biochemical, and NMR approach[J]. Journal of Medicinal Chemistry, 1999, 42(26): 5325-5337. DOI:10.1021/jm990156d |
| [9] |
Robinson D D, Winn P J, Lyne P D, et al. Self-organizing molecular field analysis:a tool for structure-activity studies[J]. Journal of Medicinal Chemistry, 1999, 42(4): 573-583. DOI:10.1021/jm9810607 |
| [10] |
Martin Y C. 3D QSAR:current state, scope, and limitations[J]. Perspectives in Drug Discovery and Design, 1998, 12/13/14: 3-23. |
| [11] |
Smith P A, Sorich M J, McKinnon R A, et al. Pharmacophore and quantitative structure-activity relationship modeling:complementary approaches for the rationalization and prediction of UDP-glucuronosyltransferase 1A4 substrate selectivity[J]. Journal of Medicinal Chemistry, 2003, 46(9): 1617-1626. DOI:10.1021/jm020397c |
| [12] |
Tuppurainen K, Viisas M, Peräkylä M, et al. Ligand intramolecular motions in ligand-protein interaction:ALPHA, a novel dynamic descriptor and a QSAR study with extended steroid benchmark dataset[J]. Journal of Computer-Aided Molecular Design, 2004, 18(3): 175-187. DOI:10.1023/B:JCAM.0000035198.11110.48 |
| [13] |
Klocker J, Wailzer Bettina, Buchbauer G, et al. Aroma quality differentiation of pyrazine derivatives using self-organizing molecular field analysis and artificial neural network[J]. Journal of Agricultural and Food Chemistry, 2002, 50(14): 4069-4075. DOI:10.1021/jf011664a |
| [14] |
Korhonen S P, Tuppurainen K, Laatikainen R, et al. Improving the performance of SOMFA by use of standard multivariate methods[J]. SAR and QSAR in Environmental Research, 2005, 16(6): 567-579. DOI:10.1080/10659360500468419 |
| [15] |
Liu G C, Xu J X, Chen N, et al. Synthesis of N6-alkyl (aryl)-2-alkyl (aryl) thioadenosines as antiplatelet agents[J]. European Journal of Medicinal Chemistry, 2012, 53: 114-123. DOI:10.1016/j.ejmech.2012.03.047 |
| [16] |
Li S L, Zheng Y. Self-organizing molecular field analysis on a new series of COX-2 selective inhibitors:1, 5-diarylimidazoles[J]. International Journal of Molecular Sciences, 2006, 7(7): 220-229. DOI:10.3390/i7070220 |
| [17] |
Li S L, He M Y, Du H G. 3D-QSAR studies on a series of dihydroorotate dehydrogenase inhibitors:analogues of the active metabolite of leflunomide[J]. International Journal of Molecular Sciences, 2011, 12(5): 2982-2993. |
| [18] |
Li S L, Zhang R T, Du H G. 3D-QSAR study on a series of VEGFR-2 kinase inhibitors:3-pyrrole substituted indolin-2-ones compounds[J]. Journal of Chemistry, 2013, 49: 374804. |
| [19] |
邓聪迩. 6-烷氨基/烷氧基-2-丙硫基-8-氮杂嘌呤核苷的合成及抗血小板凝聚活性评价[D]. 北京: 北京化工大学, 2013. Deng C E. Synthesis of 6-alkylamino/alkoxy-2-propylthio-8-azapurine and evaluation of antiplatelet agglutination activity[D].Beijing:Beijing University of Chemical Technology, 2013. (in Chinese) |
| [20] |
Douglass J G, deCamp J B, Fulcher E H, et al. Adenosine analogues as inhibitors of P2Y12 receptor mediated platelet aggregation[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(6): 2167-2171. |








