纳米二氧化钛是一种多功能半导体材料,具有无毒无害、稳定、合成简单且成本低等优点。二氧化钛的应用由化妆品到最先进的电子产品[1],用途范围广,在学术界中得到广泛研究。
制备纳米TiO2的方法有很多,如溶胶凝胶法、沉淀法、水热法、微乳法、氧化法等,其中溶胶凝胶法和水热法应用最为常见。水热法合成纳米TiO2成本低、工艺简单,通常以无机物TiOSO4、TiCl4等为原料,在密闭高温高压条件下进行反应,制备出的粉体纯度高、晶型好、形貌可控,且整个过程无需煅烧,从而避免了硬团聚的发生,还易于调节水热反应条件[2-3]。
纳米TiO2的光催化性能可以用于空气净化、废水处理、杀菌消毒等方面[4]。目前可以总结出的光催化反应机理主要有两种[5]:一种是光生电荷和空穴直接与吸附在表面上的物质发生反应,称为直接反应机理;另一种则是光生载流子与催化剂表面的氧和水分子反应生成活泼自由基,称为间接反应机理。
虽然掺杂过渡金属离子后的纳米TiO2能有效地降低光生电子-空穴的复合率,但还是会出现猝灭的现象,并且光催化降解后的纳米颗粒悬浮在溶液中,难以分离及回收再利用。近几年来,利用光电协同催化降解的方法迅速发展起来。Cheng等[6]通过将掺杂型纳米TiO2负载在多孔NaY沸石上制备成电极来测试其光电催化活性;孟红霞[7]采用导电玻璃涂覆法制成电极来检测纳米TiO2的电化学性质;还有学者通过提拉法将纳米TiO2凝胶粘附在导电玻璃上制成电极,对其电化学性质进行研究[8-10];也有研究学者通过外加电压的方式来提高纳米TiO2的降解速率[11]。但在以上几种方法中,催化剂在载体上的负载效率差,容易脱落。
为解决催化剂在载体上易脱落的问题,并评价纳米二氧化钛的光电催化效果,本文采用水热法掺杂氧化钴制备掺杂型纳米TiO2,通过掺杂拓宽了纳米TiO2对光的响应范围;使用光照-电解结合的方法来促进光催化降解反应,利用压片法将纳米TiO2催化剂制成阳电极,石墨作为阴电极,通过外加电压强化电子-空穴分离,提高光催化效率,并且制备的催化剂阳极还可以循环利用。
1 实验部分 1.1 实验原料氧化钴(CoO),≥99.9%,河南利源钴业;硫酸氧钛(TiOSO4),山东西亚化学股份有限公司;纳米二氧化钛P25,赢创-德固赛(中国)有限公司;30%过氧化氢(H2O2),氢氧化钠(NaOH),浓硫酸(H2SO4),北京化工厂;罗丹明B(C28H31ClN2O3),北京化学试剂公司。本文中所用试剂均为分析纯,实验用水为去离子水。
1.2 制备方法 1.2.1 钴掺杂纳米TiO2称取20.00 g的TiOSO4粉末,加入100 mL的去离子水,再滴入3~4滴稀硫酸(浓硫酸稀释至体积分数为10%),水浴加热直至完全溶解为溶液A。另称取一定量的CoO,加入5 mL的30%H2O2和10 mL的稀硫酸, 加热至CoO完全溶解为溶液B。将溶液B缓慢加入溶液A中,不断地搅拌均匀后, 逐滴加入NaOH稀溶液至混合溶液pH为8,加去离子水至600 mL得到白色的凝胶前驱体。陈化10 h后将前驱体转移至1 L的高压反应釜中,升温至200 ℃水热反应10 h。反应完成后冷却至室温,过滤并用去离子水洗涤至无SO42-。将产物放入烘干箱中,120 ℃烘干后研磨粉碎即可得钴掺杂纳米TiO2粉末。用此方法制备钴元素摩尔分数为0、0.1%、0.5%和1%的钴掺杂纳米TiO2,分别记为TiO2、0.1% Co-TiO2、0.5% Co-TiO2和1% Co-TiO2。
1.2.2 压片法制备催化剂阳电极称取适量的催化剂于玛瑙研钵中,加入质量分数5%的石墨粉末后进行研磨,通过0.178 mm分样筛,在8 MPa下成型,所制电极为直径1.5 cm,厚度约1 mm的圆片。将压好的圆片用银导电胶涂敷在导电玻璃(ITO)上,置于空气中自然风干备用。
1.3 催化剂的表征采用德国Zeiss公司Supra 55型场发射扫描电镜(SEM)表征样品表面形貌。测试条件:工作电压5.0 kV,放大倍数50 k。
采用丹东市百特仪器BT-90型纳米激光粒度分布仪来测定纳米颗粒粒径。测试条件:激光波长635 nm,散射角90°,测量时间180.00 s,介质为水,介质温度30 ℃,采用低速扫描。
采用德国Bruker公司的D8 Advance型X射线衍射仪(XRD)分析样品的物相组成。测试条件:铜靶辐射源(λ=0.154056 nm),工作电压40 kV,工作电流200 mA,扫描速度10(°)/min,扫描角度2θ为20°~80°。
采用美国赛默飞公司ESCALAB 250型X光电子能谱(XPS)检测样品的元素组成及价态。Alk α靶为X光源,真空度2×10-9 Pa。
采用日本岛津的UV-2401型分光光度计,以固体BaSO4作为标准物质,扫描范围220~800 nm,中速扫描。
采用上海康塔公司的SI型BET比表面仪测试样品的比表面积和孔径分布。测试条件:温度77 K,N2吸附,300 ℃下脱气12 h。
1.4 光催化活性评价配置10 mg/L的罗丹明B溶液作为污染物。取150 mL配好的罗丹明B溶液于石英烧杯中,加入0.1 mol/L的硫酸钠于溶液中作为电解质,以制备好的催化剂电极为阳极,石墨片为阴极,在武汉科斯特CS电化学工作站上以恒电位1.5 V进行电解,电解的同时打开光源和搅拌装置,通入足量空气作氧化剂。反应进行90 min,每隔15 min取一次样,用UV-752C型分光光度计(日本岛津)测吸光度,记为At。计算罗丹明B的降解率η = (A0-At) /A0 = (c0-ct) /c0,并绘制出c0/ct-t曲线,其中c0为罗丹明B溶液的初始浓度,ct为反应开始后不同时间罗丹明B溶液的浓度,t为反应时间,A0为罗丹明B溶液的初始吸光度,At为反应开始后不同时间下罗丹明B溶液的吸光度。
2 结果与讨论 2.1 钴掺杂纳米TiO2的表征结果 2.1.1 微观形貌从图 1可知,未掺杂的纳米TiO2形貌呈现为均匀的纺锤状,分散性较好,颗粒长径约200 nm,短径50~100 nm。纳米TiO2经掺杂钴后形貌由纺锤状变为球形颗粒,并随掺杂浓度的增加,颗粒的粒径减小。原因是在TiO2晶格中,随着钴杂质的掺入,晶格畸变,不易长成较大颗粒,并且形貌发生变化。当掺杂浓度为0.5%和1%时,样品形貌为球形颗粒,粒径20~50 nm,与未掺杂的纳米TiO2相比,粒径减小,比表面积增大,活性位点随之增多,有利于催化剂对反应物的吸附,并且加快了电荷迁移速率,从而更有利于催化活性的提高。

|
图 1 掺杂与未掺杂纳米TiO2的SEM照片 Fig.1 SEM images of undoped and doped nanometer TiO2 |
表 1是采用粒度分布仪所测得的样品结果。由表 1可以看到,掺杂后的纳米TiO2粒径比未掺杂时的小,并且随着掺杂浓度的增加,粒径减小,团聚现象越来越明显,此现象与图 1的结果一致。
| 下载CSV 表 1 掺杂与未掺杂纳米TiO2的粒径分布 Table 1 Particle size distribution of undoped and doped nanometer TiO2 |
由图 2可以看出,未掺杂纳米TiO2为板钛矿晶型,表明含有少量的锐钛矿晶型。随着Co元素掺杂量的增大,晶体生长受到阻碍,板钛矿所在的2θ为30.747°、30.907°、42.461°、46.147°处衍射峰分别对应的(121)、(211)、(221)、(302) 晶面的特征峰越来越弱直至消失,而锐钛矿在2θ为37.922° ((004) 晶面)、62.734° ((204) 晶面)、75.119° ((215) 晶面)等处的特征峰变得尖锐且明显。原因可能是晶体中少量Ti4+被Co原子取代而产生晶体缺陷,造成晶格畸变,使得晶体晶畴变小,峰形变宽,有利于颗粒细微化。同时XRD结果也显示,掺杂Co元素有利于高活性的锐钛矿的形成。这与Li等[12]和Xiang等[13]所得结果类似。由XRD图所得结果与2.1.1节和2.1.2节一致。
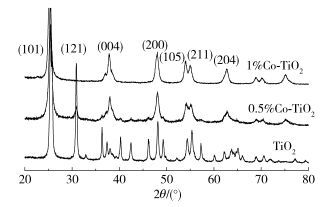
|
图 2 掺杂型纳米TiO2的XRD谱图 Fig.2 XRD patterns of doped nanometer TiO2 |
图 3是用XPS对样品中的Ti和Co元素的化学态进行的分析。图 3(a)为样品的Co 2p谱图,通过分峰拟合可以分为779.50 eV、780.60 eV和796.12 eV 3个峰,分别与Co3O42p3/2(779.5 eV)、Co(OH)22p3/2 (780.6 eV)和Co 2p1/2 (795.50 eV)相近[14],因此,样品中Co元素的化合价为+2或+3价。图 3(b)为样品的Ti 2p谱图,通过分峰拟合后发现,在464 eV和458 eV附近处出现了两个峰,分别对应Ti 2p1/2和Ti 2p3/2的结合能,这与Liu等[15]所得结果一致,因此样品中Ti的化学态为+4价。
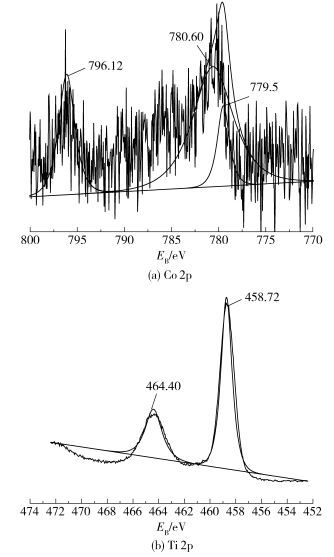
|
图 3 样品中Co 2p和Ti 2p的XPS谱图 Fig.3 Co 2p and Ti 2p XPS spectra |
如图 4所示,与P25和未掺杂TiO2样品相比,掺杂后的纳米TiO2在紫外区(0~400 nm)和可见光区(400~800 nm)的吸收都有明显的增强。通过对比光吸收曲线,P25只在小于412 nm以内有吸收,而纯TiO2样品与掺杂纳米TiO2在可见光区域有较强的吸收。由紫外-可见光谱所得数据可间接地衡量禁带宽度,根据禁带宽度Eg与光吸收阈值λg=1240/Eg关系,可得P25、TiO2、0.5% Co-TiO2和1% Co-TiO2的禁带宽度分别3.00 eV、3.00 eV、2.66 eV和2.82 eV,带隙宽度明显变窄,可能是由于Co元素的存在降低了TiO2的带隙[16]。通过对比可知,掺杂Co元素有效地拓宽了纳米TiO2对光的响应范围,进而提高了其光催化活性。
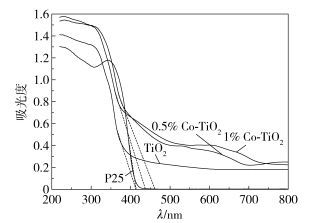
|
图 4 未掺杂和掺杂后纳米TiO2的紫外-可见吸收光谱 Fig.4 UV-vis spectra of undoped and doped nanometer TiO2 |
由图 5(a)中的N2吸附-脱附曲线可知,除P25外,其他样品都出现了滞后环且为IV型等温线,根据Brunauer-Deming-Deming-Teller (BDDT)的定义[17],本实验制备的催化剂均为介孔结构(0~20 nm)。图中纯TiO2出现的滞后环宽而短,相对压力范围在0.45~0.85之间,而掺杂后纳米TiO2比纯TiO2的滞后环向更高的相对压力(0.75~1.0) 方向移动,且更狭长,这对应于H3型滞回曲线,表明掺杂后的样品出现了裂缝[18]。这些不同点也可以从图 5(b)的孔径分布中看出,纯TiO2介孔的直径大约在0~20 nm, 掺杂后孔径有所增大。表 2列出了不同样品的孔结构信息。由表 2可知,掺杂后纳米TiO2的比表面积大大增加,0.5% Co-TiO2样品具有最大的比表面积200 m2/g,孔体积和孔径也相应的增大。此介孔结构有利于促进电子的有效传输,进而改善了纳米催化剂的催化性能。
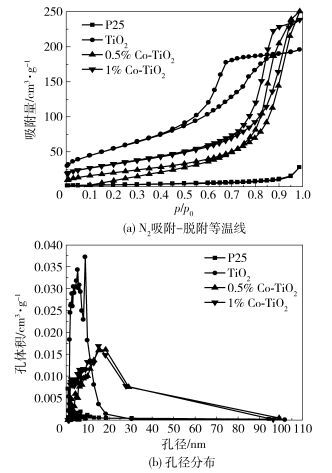
|
图 5 催化剂的吸附-脱附等温线和孔径分布图 Fig.5 Nitrogen adsorption-desorption isotherms and pore size distribution of catalysts |
| 下载CSV 表 2 不同样品的孔结构信息 Table 2 Textural properties of undoped and doped nanometer TiO2 |
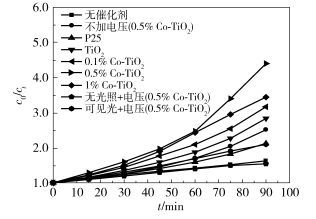
本文在恒电位1.5 V下,以低功率紫外灯(257 nm,10 W)和可见光(三基色灯,λ≥400 nm,11 W)为光源,通入空气作为氧化剂,以RhB为污染源来评价Co-TiO2的光电催化活性,结果如图 6所示。
|
图 6 不同条件下光电降解RhB曲线 Fig.6 Photoelectric degradation RhB curves under different conditions |
图 6为光电降解150 mL 10 mg/L的罗丹明B 90 min后所得曲线,从图中可以看出,从无催化剂到添加P25、TiO2、0.1% Co-TiO2、0.5% Co-TiO2和1% Co-TiO2降解率依次增大,相应的降解率数据如表 3所示。从图 6和表 3可以看出,光电降解率受CoO掺杂浓度的影响,当掺杂浓度为0.5%时,降解率最高为77.25%,比相同条件下无催化剂的降解率高38.74%,比纯TiO2样品的降解率高12.53%,比不外加电压的样品0.5% Co-TiO2的降解率高17.06%,是无光照通电压样品0.5% Co-TiO2降解率的2倍多。出现此现象主要是由于电解提高了光催化量子效率,加强了电荷与空穴的分离,在紫外灯照射下,光致空穴从纳米TiO2向钴氧化物移动,致使空穴与电荷发生分离,而钴氧化物作为助催化剂吸引空穴并参与光催化反应。在可见光的照射下0.5% Co-TiO2样品降解率达52.22%,比无光照条件下的降解率高17.15%,说明由于掺杂后的纳米TiO2对光的响应范围变宽,在可见光区域有吸收,因此可利用可见光进行光电降解。
| 下载CSV 表 3 不同催化剂光电降解90 min后的降解率 Table 3 Photoelectric degradation ratios of different photocatalysts |
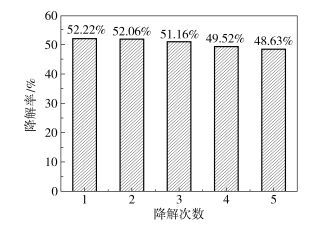
图 7是在11 W的三基色灯照射下,用0.5% Co-TiO2样品光电降解罗丹明B 90 min,循环5次实验结果。由图可知,循环5次实验后降解率由52.22%降低至48.63%,仅降低了3.59%,说明采用压片法制备的催化剂阳电极稳定性好,可以循环利用。
|
图 7 0.5% Co-TiO2样品在可见光灯下光电降解循环实验 Fig.7 Recycling performance of 0.5% Co-TiO2 under visible light |
(1) 本文制备的纳米二氧化钛形貌为纺锤状,经掺杂钴后纳米颗粒逐渐变为球形,平均粒径从182 nm减少到26.8 nm,比表面积由约77 m2/g增大至200 m2/g;晶型由未掺杂时的板钛矿逐渐转化为高活性的锐钛矿;在纳米二氧化钛的表面,钴元素主要是以CoO和Co3O4的形式存在。
(2) 掺杂钴后纳米TiO2在可见光区域有较强的吸收,带隙宽度由3.00 eV降低至2.66 eV。
(3) 样品0.5% Co-TiO2在紫外灯照射下的降解率最高,为77.25%,在可见光灯下的光电降解率为52.22%;经过5次循环实验,样品0.5% Co-TiO2在可见光灯下的降解率由52.22%降低到48%左右,具有良好的稳定性。
| [1] |
Bai Y, Mora-Seró I, De Angelis F, et al. Titanium dioxide nanomaterials for photovoltaic applications[J]. Chemical Reviews, 2014, 114(19): 10095-10130. DOI:10.1021/cr400606n |
| [2] |
Liu Y, Wei J H, Xiong R, et al. Enhanced visible light photocatalytic properties of Fe-doped TiO2 nanorod clusters and monodispersed nanoparticles[J]. Applied Surface Science, 2011, 257: 8121-8126. DOI:10.1016/j.apsusc.2011.04.121 |
| [3] |
Chae S Y, Park M K, Lee S K, et al. Preparation of size-controlled TiO2 nanoparticles and derivation of optically transparent photocatalytic films[J]. Chemistry of Materials, 2003, 15(17): 3326-3331. DOI:10.1021/cm030171d |
| [4] |
张万忠, 刘景民, 周智敏. 纳米TiO2的研究应用进展[J]. 石油化工, 2007, 36(11): 1184-1190. Zhang W Z, Liu J M, Zhou Z M. Research pogress in peparation and application of nano-titania[J]. Petrochemical Technology, 2007, 36(11): 1184-1190. (in Chinese) DOI:10.3321/j.issn:1000-8144.2007.11.020 |
| [5] |
Xu Y M, Langford C H. Variation of Langmuir adsorption constant determined for TiO2-photocatalyzed degradation of acetophenone under different light intensity[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2000, 133(1): 67-71. |
| [6] |
Cheng Z L, Han S. Preparation and photoelectrocatalytic performace of N-doped TiO2/NaY zeolite membrane composite electrode material[J]. Water Science and Technology, 2016, 73(3): 486-492. DOI:10.2166/wst.2015.505 |
| [7] |
孟红霞. 掺铁二氧化钛光催化剂的水热制备、表征及光电化学[D]. 广州: 华南理工大学, 2013. Meng H X. Hydrothermal preparation, characterization and photoelectrochemistry of Fe-doped TiO2 photocatalysts[D]. Guangzhou:South China University of Technology, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10561-1013319759.htm |
| [8] |
杨大纲, 李秋叶, 张顺利, 等. 二氧化钛纳米膜电极的形貌和光电化学性质[J]. 化学研究, 2004, 15(4): 6-9. Yang D G, Li Q Y, Zhang S L, et al. Photoelectrochemical properties and surface morphology of TiO2 nanoparticle film electrodes[J]. Chemical Research, 2004, 15(4): 6-9. (in Chinese) |
| [9] |
Chen F T, Li Y J, Liu Z, et al. Facile synthesis of TiO2/trititanate heterostructure with enhanced photoelectric efficiency for an improved photocatalysis[J]. Applied Surface Science, 2015, 341: 55-60. DOI:10.1016/j.apsusc.2015.02.182 |
| [10] |
张慧. Bi2WO6@TiO2纳米线复合催化剂的制备及光催化性能研究[D]. 哈尔滨: 哈尔滨理工大学, 2015. Zhang H. Preparation of Bi2WO6@TiO2 nanowires composite photocatalyst and study on its photocatalytic performance[D]. Harbin:Harbin University of Science and Technology, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10214-1015576753.htm |
| [11] |
Cong Y Q, Li Z, Wang Q, et al. Enhanced photoeletrocatalytic activity of TiO2 nanotube arrays modified with simple transition metal oxides (Fe2O3, CuO, NiO)[J]. Acta Physico-Chimica Sinica, 2012, 28(6): 1489-1496. |
| [12] |
Li F B, Li X Z, Ao C H, et al. Photocatalytic conversion of NO using TiO2-NH3 catalysts in ambient air environment[J]. Applied Catalysis B:Environmental, 2004, 54(4): 275-283. DOI:10.1016/j.apcatb.2004.09.006 |
| [13] |
Xiang L Y, Ya J, Hu F J, et al. Fabrication of Cu2O/TiO2 nanotube arrays with enhanced visible-light photoelectrocatalytic activity[J]. Applied Physic A, 2017, 123: 160. DOI:10.1007/s00339-017-0799-3 |
| [14] |
Moulder J F, Stickle W F, Sobol P E, et al. Handbook of X-ray photoelectron spectroscopy[M]. Eden Prairie, USA:Perkin-Elmer Corporation, 1992.
|
| [15] |
Liu X, Xu H, Grabstanowicz L R, et al. Ti3+ self-doped TiO2-x anatase nanoparticles via oxidation of TiH2 in H2O2[J]. Catalysis Today, 2014, 225: 80-89. DOI:10.1016/j.cattod.2013.08.025 |
| [16] |
Matos J, Laine J, Herrmann J M. Synergy effect in the photocatalytic degradation of phenol on a suspended mixture of titania and activated carbon[J]. Applied Catalysis B:Environmental, 1998, 18(3): 281-291. |
| [17] |
Yu J, Jimmy C Y, Leung M K P, et al. Effects of acidic and basic hydrolysis catalysts on the photocatalytic activity and microstructures of bimodal mesoporous titania[J]. Journal of Catalysis, 2003, 217(1): 69-78. |
| [18] |
Liu L C, Ji Z Y, Zou W X, et al. In situ loading transition metal oxide clusters on TiO2 nanosheets as co-catalysts for exceptional high photoactivity[J]. ACS Catalysis, 2013, 3(9): 2052-2061. DOI:10.1021/cs4002755 |








